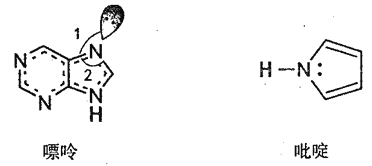
��Ŀ����
����Ŀ��ú��������Ҫ����Դ��Ҳ�ǻ�ѧ��ҵ����Ҫԭ�ϡ���ͼΪ��úΪԭ�Ϻϳ�TNT�߾���F��·�ߡ�
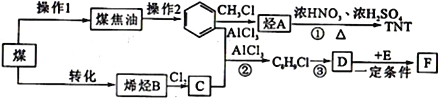
��ش��������⣺
��1������˵����ȷ����_______��
A.����1��ú�ĸ���
B.ú�������ǻ�ѧ�仯��ú��Һ���������仯
C.ú�к��б��Ͷ��ױ�������ú����ɵõ����Ͷ��ױ�
��2����![]() ������A�ķ�Ӧ������_______________��TNT�ĺ˴Ź���������________��塣
������A�ķ�Ӧ������_______________��TNT�ĺ˴Ź���������________��塣
��3��C�Ľṹ��ʽ��________________��
��4�����б������л������ʽΪC8H9Cl����������3��ȡ������ͬ���칹�����ĿΪ________�֡�
��5��E��1,3-����ϩ��F�Ǹ߷��ӻ����D��E��Ӧ�ķ���ʽ��_____________________________��
��6����д���������![]() Ϊԭ���Ʊ�������Ʒ
Ϊԭ���Ʊ�������Ʒ![]() �ĺϳ�·��_____________________________________________��
�ĺϳ�·��_____________________________________________��
���𰸡� A ȡ����Ӧ 2 CH2ClCH2Cl 6 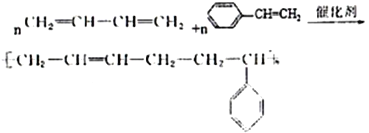
![]()
����������1��A��ú�ĸ���õ���̿(��뽹)��ú���͡��ֱ���ú���ȣ��ʲ���1��ú�ĸ���ѡ��A��ȷ��B��ú��������ú��Һ�����ǻ�ѧ�仯��ѡ��B����C��ú�в������Ͷ��ױ�����ú����ɵõ����Ͷ��ױ���ѡ��C����ѡA����2��![]() ��һ�ȼ��鷢��ȡ����Ӧ������AΪ�ױ�����Ӧ������ȡ����Ӧ��TNT���������ױ����˴Ź���������2��壻��3������C��Ӧ�����л������ʽΪC8H9Cl����C����2��̼����CΪϩ�������������ӳɷ�Ӧ���ã���C�Ľṹ��ʽ��CH2ClCH2Cl����4�����б������л������ʽΪC8H9Cl����������3��ȡ����Ϊ��������һ����ԭ�ӣ��������ڱ��������ڡ��䡢��λ���ٽ���ԭ��ȡ���ڱ����ϵ�����ֱ���2�֡�3�ֺ�1�֣���ͬ���칹�����ĿΪ6�֣���5��E��1,3-����ϩ��F�Ǹ߷��ӻ����D��E��Ӧ�ķ���ʽ��
��һ�ȼ��鷢��ȡ����Ӧ������AΪ�ױ�����Ӧ������ȡ����Ӧ��TNT���������ױ����˴Ź���������2��壻��3������C��Ӧ�����л������ʽΪC8H9Cl����C����2��̼����CΪϩ�������������ӳɷ�Ӧ���ã���C�Ľṹ��ʽ��CH2ClCH2Cl����4�����б������л������ʽΪC8H9Cl����������3��ȡ����Ϊ��������һ����ԭ�ӣ��������ڱ��������ڡ��䡢��λ���ٽ���ԭ��ȡ���ڱ����ϵ�����ֱ���2�֡�3�ֺ�1�֣���ͬ���칹�����ĿΪ6�֣���5��E��1,3-����ϩ��F�Ǹ߷��ӻ����D��E��Ӧ�ķ���ʽ��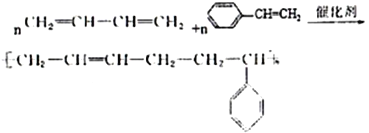 ��
��
��6��![]() �ڴ��������������������ӳɷ�Ӧ����
�ڴ��������������������ӳɷ�Ӧ����![]() ��
��![]() ���������Ƶ�ˮ��Һ�м��ȷ�Ӧ����
���������Ƶ�ˮ��Һ�м��ȷ�Ӧ����![]() ��
��![]() �����ᷢ��������Ӧ����
�����ᷢ��������Ӧ����![]() ���ϳ�·��Ϊ
���ϳ�·��Ϊ![]() ��
��

����Ŀ����֪��ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ���������������ԭ������ش��������⣺
��1�������£�Ũ�Ⱦ�Ϊ0.1molL��1������������Һ��pH���±���
���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
����������Һ�е������ӣ��������������ǿ���� ��
�ڸ��ݱ��������жϣ�Ũ�Ⱦ�Ϊ0.01molL��1�������������ʵ���Һ�У�������ǿ������������Һ�ֱ�ϡ��100����pH�仯��С���������ţ���
A��HCN B��HClO C��H2CO3 D��CH3COOH
�۾��ϱ����ݣ������ж����з�Ӧ���ܳ������������ţ���
A��CH3COOH+Na2CO3�TNaHCO3+CH3COONa
B��CH3COOH+NaCN�TCH3COONa+HCN
C��CO2+H2O+2NaClO�TNa2CO3+2HClO
��Ҫ������ˮ��HClO��Ũ�ȣ�������ˮ�м���������̼������Һ����Ӧ�����ӷ���ʽΪ ��
��2����֪������Cu��OH��2��Ksp=2��10��20 �� ��֪������ijCuSO4��Һ��c��Cu2+��=0.02molL��1 �� ���Ҫ����Cu��OH��2��������Ӧ������ҺpH������Ҫʹ0.2molL��1��CuSO4��Һ��Cu2+������Ϊ��ȫ��ʹCu2+Ũ�Ƚ���ԭ����ǧ��֮һ����Ӧ����Һ���NaOH��Һ��ʹ��ҺpHΪ ��