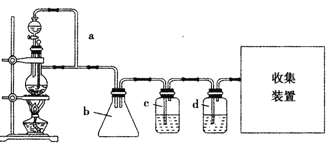
题目内容
【题目】下列溶液一定呈中性的是 ( )
A. pH=7的溶液
B. c(H+)=c(OH-)的溶液
C. 由强酸、强碱等物质的量反应得到的溶液
D. 非电解质溶于水得到的溶液
【答案】B
【解析】试题分析:A.在室温下,pH=7的溶液为中性,若温度不是室温,则pH=7的溶液不一定是中性溶液,错误。B.在任何温度下,c(H+)= c(OH-)的溶液一定为中性溶液,正确。C.强酸、强碱的元数没有确定,所以二者以等物质的量反应得到的溶液不一定是中性溶液,错误。D.非电解质溶于水若发生反应产生酸或碱,则溶液可能显酸性或碱性,因此不一定得到中性溶液,错误。

【题目】【化学一选修3: 物质结构与性质】
(1)CH3COONH2 分子中各元素第一电离能大小顺序__________,该物质中碳原子杂化方式为_______________________________。
(2)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4) 等弱碱。
N2H4 | NH3 | |
熔点/℃ | 2 | -77.8 |
沸点/℃ | 113.5 | -33.5 |
比较上表中氨(NH3)、联氨(N2H4) 的熔、沸点,解释其高低的主要原因________,![]() 的离域π键表示为________________________,与NH3 互为等电子体的阳离子有__________。
的离域π键表示为________________________,与NH3 互为等电子体的阳离子有__________。
(3)浅红色Cr [(H2O)3(NH3)3]Cl3中铬离子价电子排布式为__________________。
(4)SiC具有高硬度,高耐磨性,高耐腐蚀性和较高的高温强度特点,已成为一种重要的工程材料,其晶体具有六方ZnS 型结构。晶胞参数a=308pm,c=505pm,已知C原子的分数坐标(0,0,0)和(![]() ,
,![]() ,
,![]() );Si原子的分数坐标(0,0,
);Si原子的分数坐标(0,0,![]() )和((
)和((![]() ,
,![]() ,
,![]() )
)
①按比例在下框中商出SiC 六方晶胞_______

②列式计算Si-C的键长_______(保留整数部分)