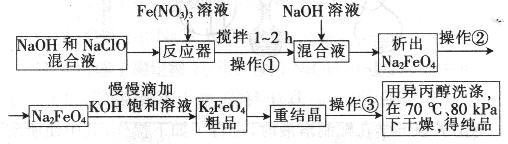
题目内容
(12分)高铁酸钾是一种高效的多功能的水处理剂。工业上常采用NaClO氧化法生产,原理为:
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
Na2FeO4+2KOH=K2FeO4+2NaOH
主要的生产流程如下:
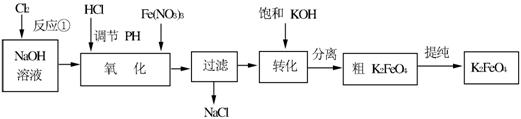
(1)写出反应①的离子方程式_____________________________。
(2)流程图中“转化”是在某低温下进行的,说明此温度下Ksp(K2FeO4) _________ Ksp(Na2FeO4)(填“>”或“<”或“=”)。
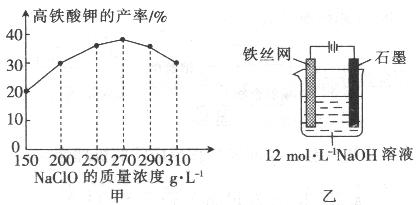
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。
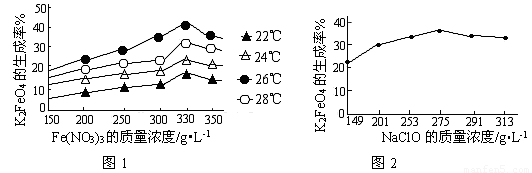
①工业生产中最佳温度为_______℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为_______。
②若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:
____________________________________________________。
若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:____________________________________。
(4)K2FeO4 在水溶液中易水解:4FeO42—+10H2O 4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______溶液(填序号)。
4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______溶液(填序号)。
A.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
(12分)
(1)Cl2+2OH—=Cl—+ClO—+H2O(2分)
(2)<(2分)
(3)①26 (1分) 1.2(1分)
②3ClO—+Fe3++3H2O=Fe(OH)3↓+3HClO (2分) 2FeO42—+Fe3++8OH—=3FeO43—+4H2O(2分)
(4)B(2分)
【解析】

 轻松暑假总复习系列答案
轻松暑假总复习系列答案