题目内容
高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备路线如下:
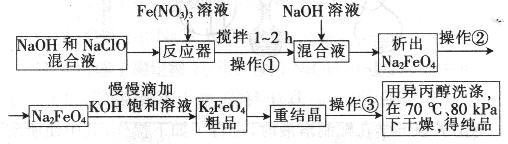
试回答下列问题
(1)操作①后的混合液中加入NaOH溶液的作用是: 。
最后用异丙醇洗涤产品的目的是 。
(2) 操作②与操作③相同,该操作名称是:___________________。
(3)反应器中,NaOH、NaClO及Fe(NO3)3反应的离子方程式为: _____________________。
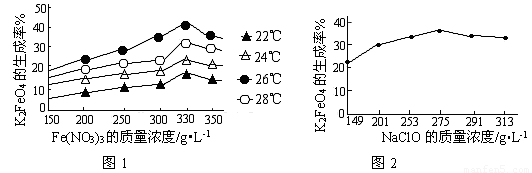
(4)次氯酸钠浓度对高铁酸钾产率有一定影响(下图甲),当高铁酸钾产率最高时,NaClO的物质的量浓度约为_________。(计算结果保留一位小数)
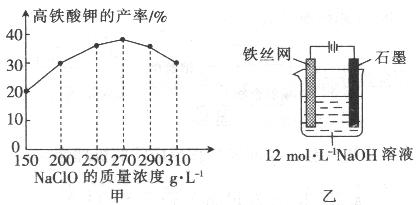
(5)从环境保护的角度看,制备中间产物Na2FeO4较好的方法为电化学法,其装置如图乙所示,则阳极的电极反应式为 。
(14分)(1)增大溶液中的钠离子浓度,便于高铁酸钠析出。(2分)
降低产品的溶解度,减少损失;加快水分挥发,易于干燥(2分) (2)过滤(2分)
(3)2Fe3+ + 3ClO─ + 10OH─ ="=" 2FeO42─ + 3Cl─ + 5H2O(3分)
(4)3.6m ol/L(2分); (5) Fe + 8OH─-6e─=FeO42─ + 4H2O(3分)
【解析】
试题分析:(1)操作①后的混合液中加入NaOH溶液,可以增大溶液中钠离子的浓度,便于高铁酸钠析出。异丙醇是有机溶剂,易挥发,所以加入异丙醇的目的是降低产品的溶解度,减少损失;加快水分挥发,易于干燥。
(2)操作②与操作③都是将固体从液体中分离出来,因此可采用过滤。
(3)次氯酸钠具有强氧化性,能把硝酸铁氧化生成高铁酸钠,反应的离子方程式是2Fe3+ + 3ClO─ + 10OH─=2FeO42─ + 3Cl─ + 5H2O。
(4)根据图甲可知,当高铁酸钾产率最高时,NaClO的质量浓度约是270/L,所以次氯酸钠大的物质的量浓度是270÷74.5=3.6mol/L。
(5)电解池中阳极失去电子,发生氧化反应,所以根据装置图可知,阳极是铁失去电子,则阳极电极反应式是Fe + 8OH─-6e─=FeO42─ + 4H2O。
考点:考查高铁酸钾制备的工艺流程图的有关判断
点评:该题以高铁酸钾的制备为载体,重点考查学生对工艺流程试题了解掌握情况。试题综合性强,贴近高考,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力以及动手操作能力,也有利于培养了学生运用知识解决实际问题的能力。






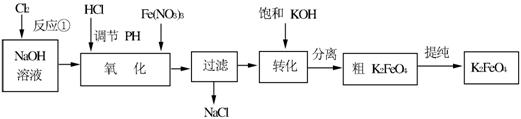
 4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______溶液(填序号)。
4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______溶液(填序号)。