题目内容
已知A、B、C、D是原子序数依次递增的短周期元素.A元素的原子半径是所有元素原子中最小的; B元素原子最外层的电子数比D的最外层电子数多1个;C元素是短周期中金属性最强的元素;D的单质是重要的半导体材料.请回答:
(1)写出B在周期表中的位置
(2)写出D的氧化物与C的最高价氧化物对应水化物反应的离子方程式
(3)1.92g Cu与B的最高价氧化物对应水化物的稀溶液充分反应,产生的气体在标准状况下的体积为
(4)某晶体甲中含有由A、B两种元素组成的常见阳离子,在实验室中检验该离子的方法是:取少量晶体甲于试管中,
(1)写出B在周期表中的位置
第二周期第ⅣA族
第二周期第ⅣA族
;(2)写出D的氧化物与C的最高价氧化物对应水化物反应的离子方程式
SiO2+2OH-=SiO32-+H2O
SiO2+2OH-=SiO32-+H2O
;(3)1.92g Cu与B的最高价氧化物对应水化物的稀溶液充分反应,产生的气体在标准状况下的体积为
0.448
0.448
L;(4)某晶体甲中含有由A、B两种元素组成的常见阳离子,在实验室中检验该离子的方法是:取少量晶体甲于试管中,
加入氢氧化钠溶液,加热,生成气体可以使湿润的红色石蕊试纸变蓝
加入氢氧化钠溶液,加热,生成气体可以使湿润的红色石蕊试纸变蓝
,则证明晶体甲中含有该阳离子.分析:A、B、C、D是原子序数依次递增的短周期元素,A元素的原子半径是所有元素原子中最小的,故A为H元素; C元素是短周期中金属性最强的元素,故C为Na元素;D的单质是重要的半导体材料,原子序数大于钠元素,故D为Si元素,B元素原子最外层的电子数比D的最外层电子数多1个,故B最外层电子数为5,原子序数小于钠元素,故B为N元素,据此解答.
解答:解:A、B、C、D是原子序数依次递增的短周期元素,A元素的原子半径是所有元素原子中最小的,故A为H元素; C元素是短周期中金属性最强的元素,故C为Na元素;D的单质是重要的半导体材料,原子序数大于钠元素,故D为Si元素,B元素原子最外层的电子数比D的最外层电子数多1个,故B最外层电子数为5,原子序数小于钠元素,故B为N元素,则
(1)B为N元素,常用周期表第二周期第ⅣA族,
故答案为:第二周期第ⅣA族;
(2)D的最高价氧化物为SiO2,C的最高价氧化物对应水化物为NaOH,二氧化硅与氢氧化钠反应生成硅酸钠与水,反应的离子方程式为SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2+2OH-=SiO32-+H2O;
(3)1.92g Cu与稀HNO3溶液充分反应生成NO气体,1.92g Cu的物质的量为
=0.03mol,根据电子转移守恒可知,生成NO的物质的量为
=0.02mol,故NO的体积为0.02mol×22.4L/mol=0.448L,
故答案为:0.448;
(4)晶体甲中含有由A、B两种元素组成的常见阳离子,故晶体甲为铵盐,在实验室中检验铵根离子的方法是:取少量晶体甲于试管中,加入氢氧化钠溶液,加热,生成气体可以使湿润的红色石蕊试纸变蓝,则证明晶体甲中含有该阳离子,
故答案为:加入氢氧化钠溶液,加热,生成气体可以使湿润的红色石蕊试纸变蓝.
(1)B为N元素,常用周期表第二周期第ⅣA族,
故答案为:第二周期第ⅣA族;
(2)D的最高价氧化物为SiO2,C的最高价氧化物对应水化物为NaOH,二氧化硅与氢氧化钠反应生成硅酸钠与水,反应的离子方程式为SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2+2OH-=SiO32-+H2O;
(3)1.92g Cu与稀HNO3溶液充分反应生成NO气体,1.92g Cu的物质的量为
| 1.92g |
| 64g/mol |
| 0.03mol×2 |
| 3 |
故答案为:0.448;
(4)晶体甲中含有由A、B两种元素组成的常见阳离子,故晶体甲为铵盐,在实验室中检验铵根离子的方法是:取少量晶体甲于试管中,加入氢氧化钠溶液,加热,生成气体可以使湿润的红色石蕊试纸变蓝,则证明晶体甲中含有该阳离子,
故答案为:加入氢氧化钠溶液,加热,生成气体可以使湿润的红色石蕊试纸变蓝.
点评:考查结构位置性质的关系,难度中等,推断元素是解题的关键,注意基础知识的掌握.

练习册系列答案
相关题目
已知A、B、C、D是原子序数依次增大的短周期主族元素,A、B、C分别在不同周期,A与C同主族,B的一种单质能使带火星的木条复燃,A、C、D三种原子的最外层电子数之和为6.下列说法不正确的是( )
| A、A的原子半径比B的小 | B、B与C形成的化合物只有一种 | C、C在化合物中呈+1价 | D、D单质的晶体可用作半导体材料 |
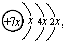 ,B是同周期中原子第一电离能最小的元素,C原子的最外层有三个未成对电子,E是人们日常生活中最常用的金属.
,B是同周期中原子第一电离能最小的元素,C原子的最外层有三个未成对电子,E是人们日常生活中最常用的金属.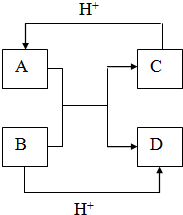 已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.
已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.