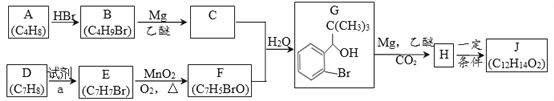
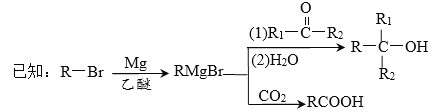
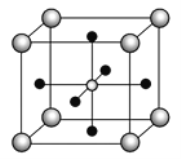
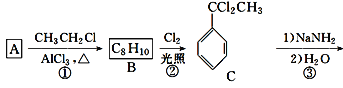
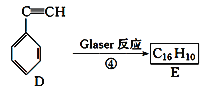
��Ŀ����
����Ŀ��Ϊ̽峹���X(�������ֳ���������Ԫ��)����ɺ�����,��Ʋ��������ʵ��:

��֪:����A��һ�ִ�����,�ڱ�״���µ��ܶ�Ϊ1.429g/L������B�ǹ��ά����Ҫ�ɷ֡���ش�:
(1)����A���ӵĵ���ʽ_______,��ɫ����D�Ļ�ѧʽ_______��
(2)����X��ϡ���ᷴӦ�����ӷ���ʽ��_______��
(3)��֪NH3������A��һ�������·�Ӧ��ɵõ�һ�������մɲ���(��������Ԫ��,Ħ������Ϊ140g/ mol)��H2,д ���÷�Ӧ �Ļ�ѧ����ʽ_______��
���𰸡�  Mg(OH)2 Mg2Si+4H+=2Mg2++SiH4�� 3SiH4+4NH3
Mg(OH)2 Mg2Si+4H+=2Mg2++SiH4�� 3SiH4+4NH3 ![]() Si3N4+12H2
Si3N4+12H2
����������֪����A�ڱ�״���µ��ܶ�Ϊ1.429g��L��1������Ħ������Ϊ1.429g��L��1��22.4L/mol
=32g/mol������B�ǹ��ά����Ҫ�ɷּ�SiO2��6.0gSiO2�����ʵ���Ϊ0.1mol����7.6gX�к�Si������Ϊ2.8g����0.1mol���ڶ����ڽ���Ԫ���У������NaOH��Ӧ���ɰ�ɫ����ֻ��Mg(OH)2���������ʵ���Ϊ0.2mol������7.6gX�к�Mg������Ϊ4.8g����0.2mol���ɴ���֪XΪMg2Si���������ᷴӦ���ɵ�A����ΪSiH4����Ħ������ǡ��Ϊ32g/mol��
(1)SiH4�ĵ���ʽΪ ����ɫ����D�Ļ�ѧʽΪMg(OH)2��
����ɫ����D�Ļ�ѧʽΪMg(OH)2��
(2)����X��ϡ���ᷴӦ�����ӷ���ʽ��Mg2Si+4H+=2Mg2++SiH4����
(3)NH3��SiH4��һ�������·�Ӧ����һ�������մɲ��Ϻ�H2�����������մɲ����к���Si��N����Ԫ�أ����ݶ��ߵĻ��ϼۿ�֪���仯ѧʽΪSi3N4��Ħ������Ϊ140g/ mol�����Է�Ӧ�Ļ�ѧ����ʽΪ3SiH4+4NH3 ![]() Si3N4+12H2��
Si3N4+12H2��

 ��ʦ����ָ���ο�ʱϵ�д�
��ʦ����ָ���ο�ʱϵ�д�����Ŀ����������ƣ�Na2S2O3��5H2O�����������մ��ֳ�Ϊ������������������ˮ���������Ҵ������ȡ�������ֽ⡣ijʵ����ģ�ҵ���ȡ��������ƣ��䷴Ӧװ�ü������Լ�����ͼ��
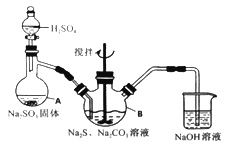
ʵ������������Ϊ��
�ٿ�����Һ©����ʹ�����������£��ʵ����ڷ�Һ�ĵ��٣�ʹ��Ӧ������SO2����Ͼ��ȵ�ͨ��Na2S��Na2CO3�Ļ����Һ�У�ͬʱ�����綯������������ˮԡ���ȣ��С�
��ֱ�������Ļ��Dz�����ʧ����������Һ��pH�ӽ�7ʱ��ֹͣͨ��SO2���塣
����
��1�������A������_______��
��2��Ϊ�˱�֤��������ƵIJ�����ʵ���в�������ҺpH <7���������ӷ���ʽ����ԭ��_________��
��3��д��������ƿB����ȡNa2S2O3����Ӧ���ܻ�ѧ��Ӧ����ʽ________��
��4����������������Һ�л�ýϸ߲���Na2S2O3��5H2O�IJ���Ϊ
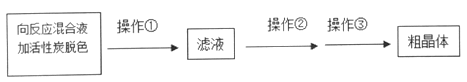
Ϊ���ٲ�Ʒ����ʧ��������Ϊ���ȹ��ˣ�����������ԭ����______����������______���������dz��ˡ�ϴ�ӡ����
��5���ⶨ��Ʒ����
ȡ6.00g��Ʒ�����Ƴ�100mL��Һ��ȡ10.00mL��Һ���Ե�����ҺΪָʾ������Ũ��Ϊ0.500mol/LI2�ı���Һ���еζ�����Ӧԭ��Ϊ2S2O32-+I2=S4O62-+2I-��������ݼ�¼���±���ʾ��
��� | 1 | 2 | 3 |
��Һ�����/mL | 10.00 | 10.00 | 10.00 |
����I2����Һ�����/mL | 19.98 | 22.50 | 20.02 |
�ζ�ʱ���ﵽ�ζ��յ��������___________����Ʒ�Ĵ���Ϊ____________��
��6��Na2S2O3������������������Һ���ױ�Cl2������SO42-���÷�Ӧ�����ӷ���ʽΪ_________��