题目内容
【题目】下列为制取溴苯实验的有关现象的叙述和解释,其中正确的是( )
A.实验室制取的溴苯的实验后液体呈褐色,由于产物溴苯是褐色的
B.溴苯比水轻,因此溴苯浮在水面上
C.实验室制取溴苯时,导管口出现白雾,是由于HBr遇水蒸气而形成的
D.溴苯和苯的混合物可以用水萃取分离
【答案】C
【解析】
A. 溴苯是无色液体,溴苯中溶有溴而呈褐色,故A错误;
B. 溴苯是无色液体,密度大于水,和水不互溶,所以溴苯在水的下方,故B错误;
C. 溴和苯发生取代反应生成溴苯和HBr,HBr遇水蒸气生成氢溴酸小液滴而产生白雾,故C正确;
D. 溴苯和苯都不溶于水,所以不能采用萃取方法分离,应该采用蒸馏方法分离,故D错误;
正确答案是C。

【题目】硫酰氯(SO2Cl2)和亚硫酰氯(SOCl2)常用作氯化剂,都可用于医药、农药、染料工业及有机合成工业。亚硫酰氯还用于制锂亚硫酰氯(Li/SOCl2)电池。
有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 具有吸水性且难分解 |
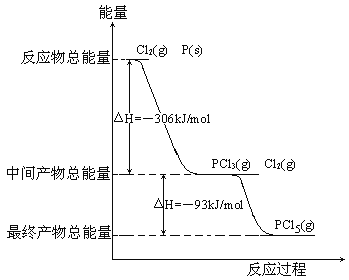
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,反应的热化学方程式为:SO2(g)+Cl2(g) ![]() SO2Cl2(l) △H= - 97.3 kJ·mol-1。反应装置如图所示(夹持仪器已省略),请回答有关问题:
SO2Cl2(l) △H= - 97.3 kJ·mol-1。反应装置如图所示(夹持仪器已省略),请回答有关问题:
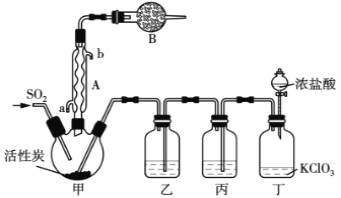
(1)仪器A的名称为___________;
(2)仪器B的作用是_____________________;
(3)装置丙中盛放的试剂为____________,在实验室用氢氧化钠吸收多余硫酰氯反应的离子方程式为___________________;
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_________(填序号)
①先通冷凝水,再通气体 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的实验操作名称为__________________,
②设计实验方案检验氯磺酸分解制取硫酰氯产品中混有硫酸,下列方案合理的是:_____(填字母)
A.取样品溶于水,滴加紫色石蕊溶液变红:再取少量溶液,加入BaCl2溶液产生白色沉淀,说明含有H2SO4。
B.取样品在干燥条件下加热至完全反应,冷却后直接加BaCl2溶液,有白色沉淀,再滴加紫色石蕊溶液变红,说明含有H2SO4。
(6)Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解质溶液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2===4LiCl+S+SO2。
①写出该电池正极发生的电极反应式_______________________________
②组装该电池必须在无水、无氧的条件下进行,原因是__________________