题目内容
在0.lmol•L-1Na2CO3溶液中,下列关系正确的是 ( )
A.[Na+]=2[CO32- ] B.[OH一 ]=2[H+]
C.[HCO3- ]>[H2CO3] D.[Na+]<([CO32-]+[HCO3- ])
C
【解析】在碳酸钠溶液中存在CO32-的水解平衡,由于CO32-的水解分两步,且第一步水解程度大于第二步的水解程度,根据水解方程式CO32-+H2O HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-可知选项C是正确的,根据物料守恒可知D是错误的,应该是c(Na+])=c(CO32-)+c(HCO3-)+c(H2CO3) 。答案选C。
H2CO3+OH-可知选项C是正确的,根据物料守恒可知D是错误的,应该是c(Na+])=c(CO32-)+c(HCO3-)+c(H2CO3) 。答案选C。

 浙江名校名师金卷系列答案
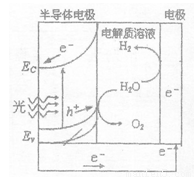
浙江名校名师金卷系列答案A、B、C、D是短周期元素形成的四种气体单质,其它物质为化合物。H常作为普通锌锰干电池的电解质。有关的转化关系如下图所示(反应条件均已略去)。
请回答下列问题:
(1)B的结构式为____ ,G的化学式为 。
(2)Y和E在一定条件下可反应生成B和Z,该反应的化学方程式为 。
(3)在体积为0.5L的恒容密闭容器中,充人1.25molB和1.25molD进行如下化学反应:
B(g)+3D(g)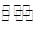 2Y(g),其化学平衡常数K与T的关系如下表所示:
2Y(g),其化学平衡常数K与T的关系如下表所示:
|
T/℃ |
300 |
400 |
|
K |
3.41 |
0.50 |
①若反应在400℃下进行,下列各项中能作为判断该反应达到化学平衡状态依据的是
(填字母)。
A.Y、B、D的物质的量分别为0.50mol、l.0mol、0.50mol
B.v正(B)= 3v 逆(D)
C.容器内压强保持不变
D.混合气体的密度保持不变
②在一定条件下B(g)+3D(g)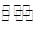 2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
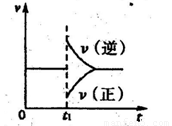
A.维持温度、反应体系体积不变,t1时充入Y(g)
B.维持压强不变,tl时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入Y(g)
(4)0.lmol·L-1的X溶液和0.2mol·L-1的Y溶液等体积混合后显碱性,则该混合溶液中各离子浓度大小顺序是 .
(5)常温下,0.1mol·L-1的Y溶液中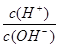 =l×10-8,下列叙述中错误的是 ( )
=l×10-8,下列叙述中错误的是 ( )
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度为0.1mol·L-1
C.该溶液中水电离出的c(H+)与c(OH—)乘积为l×10-22
D.pH=l的X溶液V1L与0.1mol·L-1的Y溶液V2L混合,若混合溶液pH =7,则V1<V2
E.将0.1mol·L-1的Y溶液加水稀释100倍后,pH >9