题目内容
(1)25℃时,在酸性、碱性、中性溶液中,C(H+)?C(OH-)=
某温度下纯水中的C(H+)=2×10-7mol/L,则此时溶液中的C(OH-)=
(2)室温下取0.2mol?L-1HCl溶液与0.2mol?L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中水电离出的c(H+)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=
(3)室温下如果取0.2mol?L-1 MOH溶液与0.1mol?L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度
(4)室温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=7,则强碱与强酸的体积比是
10-14
10-14
.某温度下纯水中的C(H+)=2×10-7mol/L,则此时溶液中的C(OH-)=
2×10-7mol/L
2×10-7mol/L
mol/L;若温度不变,滴入稀盐酸,使c(H+)=5×10-4mol/L,则溶液中C(OH-)=8×10-11mol/L
8×10-11mol/L
mol/L,pH=8×10-11mol/L
8×10-11mol/L
.(2)室温下取0.2mol?L-1HCl溶液与0.2mol?L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中水电离出的c(H+)
>
>
0.2mol?L-1 HCl溶液中水电离出的c(H+);(填“>”、“<”、或“=”)②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=
9.9×10-7
9.9×10-7
mol?L-1 c(H+)-c(MOH)=1.0×10-8
1.0×10-8
mol?L-1(3)室温下如果取0.2mol?L-1 MOH溶液与0.1mol?L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度
<
<
MCl的水解程度.(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为c(Cl-)>c(M+)>c(H+)>c(OH-)
c(Cl-)>c(M+)>c(H+)>c(OH-)
.(4)室温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=7,则强碱与强酸的体积比是
1:10
1:10
.分析:(1)C(H+)?C(OH-)=Kw,纯水溶液中氢离子浓度始终等于氢氧根离子浓度,温度不变,水的离子积常数不(1)C(H+)?C(OH-)=Kw,纯水溶液中氢离子浓度始终等于氢氧根离子浓度,温度不变,水的离子积常数不变;
(2)室温下取0.2mol?L-1HCl溶液与0.2mol?L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,说明得到的盐是强酸弱碱盐,其溶液呈酸性,含有弱根离子的盐促进水电离;
根据物料守恒和电荷守恒计算离子浓度大小;
(3)室温下如果取0.2mol?L-1 MOH溶液与0.1mol?L-1 HCl溶液等体积混合,溶液中的溶质是MCl和MOH,测得混合溶液的pH<7,说明碱的电离程度小于盐的水解程度,根据电荷守恒判断离子浓度大小;
(4)室温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=7,说明氢离子和氢氧根离子物质的量相等,据此计算其体积之比.
(2)室温下取0.2mol?L-1HCl溶液与0.2mol?L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,说明得到的盐是强酸弱碱盐,其溶液呈酸性,含有弱根离子的盐促进水电离;
根据物料守恒和电荷守恒计算离子浓度大小;
(3)室温下如果取0.2mol?L-1 MOH溶液与0.1mol?L-1 HCl溶液等体积混合,溶液中的溶质是MCl和MOH,测得混合溶液的pH<7,说明碱的电离程度小于盐的水解程度,根据电荷守恒判断离子浓度大小;
(4)室温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=7,说明氢离子和氢氧根离子物质的量相等,据此计算其体积之比.
解答:解:解:(1)25℃时,在酸性、碱性、中性溶液中,C(H+)?C(OH-)=10-14,某温度下纯水中的C(H+)=2×10-7mol/L,纯水中C(H+)=C(OH-),所以此时溶液中的C(OH-)=2×10-7 mol/L,
若温度不变,滴入稀盐酸,使c(H+)=5×10-4mol/L,则溶液中C(OH-)=8×10-11mol/Lmol/L,pH=4-lg5,
故答案为:10-14,2×10-7,8×10-11,4-lg5;
(2)①等体积等浓度的盐酸和MOH恰好反应生成盐,得到的盐溶液呈酸性,说明该盐是强酸弱碱盐,含有弱根离子的盐促进水电离,酸抑制水电离,所以混合溶液中水电离出的c(H+)>0.2 mol?L-1 HCl溶液中水电离出的c(H+),
故答案为:>;
②根据电荷守恒得c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=9.9×10-7mol?L-1,根据质子守恒得 c(H+)-c(MOH)=c(OH-)=1.0×10-8mol?L-1,
故答案为:9.9×10-7,1.0×10-8;
(3)室温下如果取0.2mol?L-1 MOH溶液与0.1mol?L-1 HCl溶液等体积混合,溶液中的溶质是MCl和MOH,测得混合溶液的pH<7,说明碱的电离程度小于盐的水解程度,溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒知
c(Cl-)>c(M+),盐中阴阳离子浓度大于氢离子和氢氧根离子浓度,所以溶液中各离子浓度由大到小的顺序为c(Cl-)>c(M+)>c(H+)>c(OH-),
故答案为:<,c(Cl-)>c(M+)>c(H+)>c(OH-);
(4)室温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=7,则氢离子和氢氧根离子的物质的量相等,碱溶液中氢氧根离子浓度是0.1mol/L,酸中氢离子浓度是0.01mol/L,则强碱与强酸的体积比是 1:10,
故答案为:1:10.
若温度不变,滴入稀盐酸,使c(H+)=5×10-4mol/L,则溶液中C(OH-)=8×10-11mol/Lmol/L,pH=4-lg5,
故答案为:10-14,2×10-7,8×10-11,4-lg5;
(2)①等体积等浓度的盐酸和MOH恰好反应生成盐,得到的盐溶液呈酸性,说明该盐是强酸弱碱盐,含有弱根离子的盐促进水电离,酸抑制水电离,所以混合溶液中水电离出的c(H+)>0.2 mol?L-1 HCl溶液中水电离出的c(H+),
故答案为:>;
②根据电荷守恒得c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=9.9×10-7mol?L-1,根据质子守恒得 c(H+)-c(MOH)=c(OH-)=1.0×10-8mol?L-1,
故答案为:9.9×10-7,1.0×10-8;
(3)室温下如果取0.2mol?L-1 MOH溶液与0.1mol?L-1 HCl溶液等体积混合,溶液中的溶质是MCl和MOH,测得混合溶液的pH<7,说明碱的电离程度小于盐的水解程度,溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒知
c(Cl-)>c(M+),盐中阴阳离子浓度大于氢离子和氢氧根离子浓度,所以溶液中各离子浓度由大到小的顺序为c(Cl-)>c(M+)>c(H+)>c(OH-),
故答案为:<,c(Cl-)>c(M+)>c(H+)>c(OH-);
(4)室温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=7,则氢离子和氢氧根离子的物质的量相等,碱溶液中氢氧根离子浓度是0.1mol/L,酸中氢离子浓度是0.01mol/L,则强碱与强酸的体积比是 1:10,
故答案为:1:10.
点评:本题考查了弱电解质的电离、离子浓度大小的比较等知识点,难度较大,根据电荷守恒和物料守恒来分析解答.

练习册系列答案
相关题目
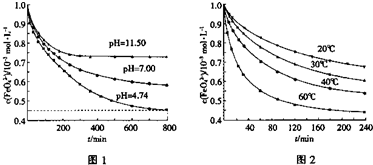
 4Fe(OH)3+8OH—+3O2
4Fe(OH)3+8OH—+3O2