题目内容
(07年天津卷)(14分)黄铁矿主要成分是FeS2 。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量‘Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。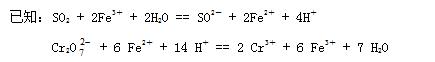
⑴.样品中FeS2的质量分数是(假设杂质不参加反应)________________。
⑵.若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4 ,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式:______________________________________________________________________。
⑶.煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________L,制得98%的硫酸质量为__________ t ,SO2全部转化为H2SO4时放出的热量是_______ kJ。
答案:(14分)(1)90.00%
(2)SO3(g)+H2O(l)=H2SO4(l);△H=-130.3kJ?mol-1
(3)3.36×105 15 3.43×107
解析:本题属综合计算题。(1)由多步反应可得:
3FeS2 ~ 2Cr2O72-
3×120 2mol
m(FeS2) 0.02000mol/L×0.025L
可求得m(FeS2)=0.0900g,故其质量分数为90.00%
(2)由原子守恒可得6gFeS2完全反应制得的SO3为0.1mol,故1molSO3气体转化为H2SO4时放出的热量为130.3kJ,在书写热化学方程式时应注意其状态的标注、△H的正负和单位。
(3)由多步反应可得:FeS2 ~ 2SO2 ~ 2H2SO4
120 44.8 196
1×107g×90% V(SO2) m(H2SO4)
列比例式计算可得:V(SO2)=3.36×105 L m(H2SO4)= 15 t
经计算生成的 n(H2SO4)=1.5×105 mol,而1molSO2全部转化为H2SO4时放出的热量为98.3kJ+130.3kJ=228.6kJ,所以SO2全部转化为H2SO4时放出的热量为:1.5×105 mol×228.6kJ/mol=3.43×107 kJ。
高考考点:综合计算
易错提醒:不能很好的利用多步反应的计算技巧,导致计算量大且计算结果出错
备考提示:本题是多步反应计算的一个典型,我们应抓住原子守恒的实质,可大大减小计算量和出错的概率。热化学方程式的书写应注意的几个问题:方程式应配平,标明物质的状态,△H放热为负、吸热为正,并要注意其单位(常用kJ?mol-1)。

① 将干燥的氯气在110℃ ~ 140℃与硫反应,即可得S2C12粗品。
② 有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
S | 112.8 | 444.6 | 略 |
S2C12 | -77 | 137 | 遇水生成HCl、SO2、S; 300℃以上完全分解; S2C12 + C12 |
设计实验装置图如下:

⑴.上图中气体发生和尾气处理装置不够完善,请你提出改进意见____________________________________________________________________________。
利用改进后的正确装置进行实验,请回答下列问题:
⑵.B中反应的离子方程式:_________________________________________________;
E中反应的化学方程式:_________________________________________________。
⑶.C、D中的试剂分别是__________________________、_______________________。
⑷.仪器A、B的名称分别是____________、____________,F的作用是___________。
⑸.如果在加热E时温度过高,对实验结果的影响是_____________________________,
在F中可能出现的现象是________________________________________________。
⑹.S2C12粗品中可能混有的杂质是(填写两种)______________、________________,为了提高S2C12的纯度,关键的操作是控制好温度和______________________________。