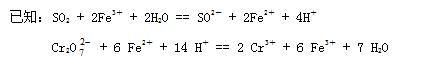题目内容
(07年天津卷)25 ℃时,水的电离达到平衡:H2O ![]() H+ + OH- ;ΔH > 0 ,下列叙述正确的是()
H+ + OH- ;ΔH > 0 ,下列叙述正确的是()
A.向水中加人稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加人少量固体CH3COONa ,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
答案:B
解析:水的电离是吸热反应,所以升温可促使水的电离平衡向正方向移动。而酸碱可抑制水的电离,弱电解质的离子可促进水的电离。A项中加入稀氨水,平衡逆向移动,但c(OH-)增大,A项错误。硫酸氢钠在水溶液中可完全电离产生H+,所以c(H+)增大,温度不变则KW不变。C项中的CH3COO-可促进水的电离平衡应向正方向移动,故C项错误。D项中将水加热,水的电离程度增大,KW增大,c(H+)与c(OH-)同等程度增大,PH减小,D项错误。
高考考点:本题考查了水的电离平衡与外界条件的关系。
易错提醒:Kw是一个常数,只与温度有关,易错选D;
备考提示:化学平衡、电离平衡、水解平衡是高考的热点,要理解和应用勒夏特列原理来解决此类问题。

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目