题目内容
【题目】I.写出下列典型物质的电离方程式
(1)H2SO4_________________________________________
(2)Fe(OH)3________________________________________
(3)NaHSO4_________________________________________
(4)NaHCO3________________________________________
(5)Al2O3(熔融)____________________________________
II.写出下列典型反应的离子方程式:
(1)在稀H2SO4中加入CH3COONa溶液___________________________________
(2)氧化镁溶于稀硫酸______________________________________________
(3)CuSO4溶液与Ba(OH)2溶液混合_______________________________________
(4)NaHCO3溶液与稀盐酸混合________________________________________
(5)NaHSO4溶液与NaOH溶液混合_____________________________________
【答案】H2SO4===2H++SO42- Fe(OH)3![]() Fe3++3OH- NaHSO4===Na++H++SO42- NaHCO3===Na++HCO3-、 Al2O3
Fe3++3OH- NaHSO4===Na++H++SO42- NaHCO3===Na++HCO3-、 Al2O3![]() 2Al3++3O2- CH3COO-+H+===CH3COOH MgO+2H+===Mg2++H2O Cu2++SO42-+Ba2++2OH-===Cu(OH)2↓+BaSO4↓ HCO3-+H+===H2O+CO2↑ H++OH-===H2O
2Al3++3O2- CH3COO-+H+===CH3COOH MgO+2H+===Mg2++H2O Cu2++SO42-+Ba2++2OH-===Cu(OH)2↓+BaSO4↓ HCO3-+H+===H2O+CO2↑ H++OH-===H2O
【解析】
I. (1)硫酸为强电解质,在溶液中完全电离;
(2)Fe(OH)3为多元弱碱,则电离方程式为Fe(OH)3![]() Fe3++3OH-;
Fe3++3OH-;
(3)NaHSO4是强电解质,完全电离;
(4)碳酸氢钠是弱酸强碱酸式盐,是强电解质完全电离;
(5) Al2O3(熔融)是强电解质,熔融时完全电离;
II. (1) H2SO4和CH3COONa溶液反应反应生成醋酸和硫酸钠,醋酸是弱酸不能拆,硫酸钠是强电解质要拆;
(2)氧化镁溶于稀硫酸生成硫酸镁和水,硫酸和硫酸镁是强电解质,在离子方程式里要拆;
(3) CuSO4溶液与Ba(OH)2溶液混合生成硫酸钡沉淀和氢氧化铜沉淀;
(4) 碳酸氢钠和盐酸反应生成二氧化碳、水和氯化钠;
(5) NaHSO4溶液与NaOH溶液混合生成硫酸钠和水,NaHSO4是强电解质在溶液中电离出氢离子、钠离子和硫酸根离子,硫酸钠是强电解质在离子方程式中要拆。
I. (1)硫酸为强电解质,在溶液中完全电离,其电离方程式为:H2SO4===2H++SO42-,故答案为:H2SO4===2H++SO42-;
(2)Fe(OH)3为多元弱碱,则电离方程式为Fe(OH)3![]() Fe3++3OH-,故答案为:Fe(OH)3
Fe3++3OH-,故答案为:Fe(OH)3![]() Fe3++3OH-;
Fe3++3OH-;
(3)NaHSO4是强电解质,完全电离,电离方程式为NaHSO4===Na++H++SO42-,故答案为:NaHSO4===Na++H++SO42-;
(4)碳酸氢钠是弱酸强碱酸式盐,是强电解质完全电离;电离方程式为:NaHCO3===Na++HCO3-;故答案为:NaHCO3===Na++HCO3-;
(5) Al2O3(熔融)是强电解质,熔融时完全电离,电离方程式为:Al2O3 ![]() 2Al3++3O2-;故答案为:NaHCO3===Na++HCO3-;
2Al3++3O2-;故答案为:NaHCO3===Na++HCO3-;
II. (1) H2SO4和CH3COONa溶液反应反应生成醋酸和硫酸钠,醋酸是弱酸不能拆,硫酸钠是强电解质要拆,离子反应为CH3COO-+H+=CH3COOH;
(2)氧化镁溶于稀硫酸生成硫酸镁和水,硫酸和硫酸镁是强电解质,在离子方程式里要拆,离子方程式为:MgO+2H+===Mg2++H2O;
(3) CuSO4溶液与Ba(OH)2溶液混合生成硫酸钡沉淀和氢氧化铜沉淀,离子方程式为:Cu2++SO42-+Ba2++2OH-===Cu(OH)2↓+BaSO4↓;
(4) 碳酸氢钠和盐酸反应生成二氧化碳、水和氯化钠,反应的化学方程式为:NaHCO3+HCl=CO2↑+H2O+NaCl;碳酸氢钠、氯化氢都是可溶性的强电解质,离子方程式中需要拆开,二氧化碳、水需要保留分子式,该反应的化离子方程式:HCO3-+H+==CO2↑+H2O;
(5) NaHSO4溶液与NaOH溶液混生成硫酸钠和水,NaHSO4是强电解质在溶液中电离出氢离子、钠离子和硫酸根离子,硫酸钠是强电解质在离子方程式中要拆,该反应的化离子方程式:H++OH-===H2O。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】请按要求填写下列空白:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________________________________________;
(2)写出元素②的最简单氢化物的结构式_________________________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式____________。
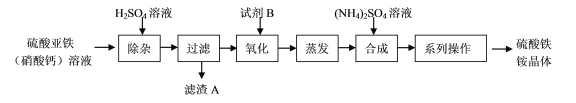
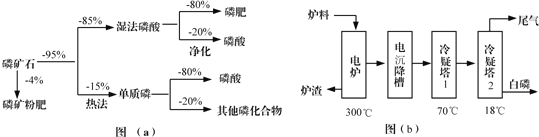
【题目】化学一选修:化学与技术磷矿石主要以[Ca3(PO4)2H2O]和磷灰石[Ca5F(PO4)3,Ca5(OH)(PO4)3]等形式存在,图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸,图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程:
部分物质的相关性质如下:
熔点/℃ | 沸点/℃ | 备注 | |
白磷 | 44 | 280.5 | |
PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
SiF4 | -90 | -86 | 易水解 |
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的____________;
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为:___________,现有1t折合含有P2O5约30%的磷灰石,最多可制得到85%的商品磷酸___________t。
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷,炉渣的主要成分是___________(填化学式),冷凝塔1的主要沉积物是___________,冷凝塔2的主要沉积物是___________。
(4)尾气中主要含有___________,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去___________;再通入次氯酸钠溶液,可除去___________(均填化学式)。
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是___________。