题目内容
【题目】将饱和的Fe Cl3溶液逐滴滴入沸水中,液体变为红褐色 :
(1)写出反应的化学方程式_____。
(2)将其装入U形管内,用石墨棒做电极,接通直流电源,通电一段时间后发现阴极附近颜色_____,这表明__________,这种现象称为_____。
(3)向其中逐滴加入过量稀硫酸,现象是______;原因是__________。
【答案】FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl 加深 Fe(OH)3胶粒带正电 电泳 先出现红褐色沉淀,随后沉淀逐渐溶解,溶液呈棕黄色 先出现胶体的聚沉现象,随后Fe(OH)3与稀硫酸发生复分解反应而溶解
Fe(OH)3(胶体)+3HCl 加深 Fe(OH)3胶粒带正电 电泳 先出现红褐色沉淀,随后沉淀逐渐溶解,溶液呈棕黄色 先出现胶体的聚沉现象,随后Fe(OH)3与稀硫酸发生复分解反应而溶解
【解析】
(1)将饱和Fe Cl3溶液逐滴滴入沸水中生成氢氧化铁胶体;
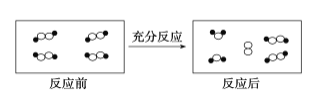
(2))胶体粒子带电荷,能发生电泳;
(3))胶体遇电解质溶液发生聚沉现象,氢氧化铁沉淀能硫酸反应生成可溶性硫酸铁和水;
(1)将饱和Fe Cl3溶液逐滴滴入沸水中,继续加热,得到红褐色的液体为氢氧化铁胶体,反应方程式是FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
(2)异种电荷相互吸引,通电一段时间后发现阴极附近颜色加深,氢氧化铁胶粒移向阴极,说明Fe(OH)3胶粒带正电,这种现象称为电泳;
(3)胶体遇电解质溶液发生聚沉现象,氢氧化铁沉淀能硫酸反应生成可溶性硫酸铁和水,向氢氧化铁胶体中逐滴加入过量稀硫酸,先出现胶体的聚沉现象,随后Fe(OH)3与稀硫酸发生复分解反应而溶解,现象是先出现红褐色沉淀,随后沉淀逐渐溶解,溶液呈棕黄色。

练习册系列答案
相关题目