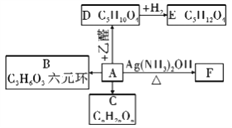
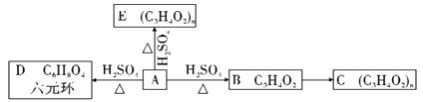
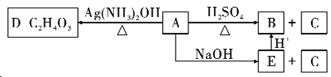
题目内容
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如下表所示,这四种元素原子的最外层电子数之和为21。请用化学用语回答下列问题:
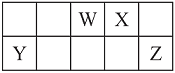
(1)写出W含有8个中子的核素的化学符号_____________。
(2)元素Z的最高价氧化物对应的水化物的化学式为_____________。
(3)在X、Y、Z三种元素中,其离子半径按由大到小的排列顺序为________________。
(4)X、Z的气态氢化物沸点较高是________,原因是____________________。
(5)化合物Y2X3中含有的化学键类型是________。工业上冶炼Y单质的方法是________(填字母)。
A.重力沉降法 B.热分解法 C.热还原法 D.电解法
(6)水中锰含量超标,容易使洁具和衣物染色、使水产生异味。ZX2可以用来除去水中超标的Mn2+,生成一种黑色沉淀,同时测得消耗13.50g ZX2时,共转移了1mol电子,则反应的离子方程式是___________________________________。
【答案】 ![]() HClO4 r(Cl-)> r(O2-)> r(Al3+) H2O 水分子间形成氢键,使分子间作用力增大,沸点升高 离子键 D 2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+
HClO4 r(Cl-)> r(O2-)> r(Al3+) H2O 水分子间形成氢键,使分子间作用力增大,沸点升高 离子键 D 2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+
【解析】(1)根据质量数=质子数+中子数关系,写出氮元素含有8个中子的核素的化学符号。
(2)元素氯的最高价氧化物对应的水化物为高氯酸。
(3)电子层数越多,半径越大;核外电子排布相同的离子,核电荷数越大,离子半径越小。
(4)水分子间有氢键,熔沸点较高。
(5)氧化铝为离子化合物,电解熔融的氧化铝可以得到金属铝。
详解:根据元素在周期表中的位置及四种元素原子的最外层电子数之和为21可知:X为氧,Y为铝,Z为氯;W为氮;
(1) W为氮元素,氮的核电荷数为7,质量数为7+8=15,所以含有8个中子的核素的化学符号![]() ;正确答案:
;正确答案:![]() 。
。
(2) 元素Z为氯,氯的最高价氧化物对应的水化物的化学式为HClO4;正确答案:HClO4。
(3)核外电子排布相同的离子,核电荷数越大,离子半径越小,电子层数越多,半径越大,r(Cl-)>r(O2-)>r(Al3+);正确答案:r(Cl-)>r(O2-)>r(Al3+)。
(4) X的气态氢化物为水,Z的气态氢化物为氯化氢,由于水分子间形成氢键,使分子间作用力增大,沸点升高,所以X、Z的气态氢化物沸点较高是H2O;正确答案:H2O;水分子间形成氢键,使分子间作用力增大,沸点升高。
(5) 化合物Y2X3为氧化铝,属于离子化合物,含有离子键;工业上电解熔融的氧化铝得到金属铝和氧气;正确答案:离子键;D。
(6) ZX2为ClO2,物质的量为13.50/67.5=0.2mol,转移电子1mol电子,则1molClO2完全反应转移电子5mol,所以ClO2由+4价降低-1价,Mn2+被氧化生成二氧化锰,反应离子方程式:2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+;正确答案:2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+。

【题目】温度为T时,在4.0L恒容密闭容器中充入2.0mol PCl5 , 发生反应:PCl5(g)PCl3(g)+Cl2(g),反应时间(t)与容器内气体总压强(p)的数据见表:
t/s | 0 | 50 | 150 | 250 | 350 |
总压强p/100kPa | 100 | 116 | 119 | 120 | 120 |
(1)由总压强p和起始压强p0计算反应物PCl5的转化率α(PCl5)的表达式为?平衡时PCl5的转化率为多少?
(2)反应在前50s的平均速率v(PCl3)为多少?
(3)该温度下的平衡常数为多少?