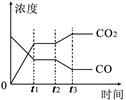
题目内容
已知在一密闭容器中充入1 mol CO2和3 mol H2,在高温时气体混合物达到平衡:CO2 + H2 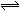 CO + H2O,已知达平衡时生成0.75 mol CO,则当H2 改为9 mol 时,在上述条件下重新达平衡时,生成CO和水蒸气物质的量之和可能为( )
CO + H2O,已知达平衡时生成0.75 mol CO,则当H2 改为9 mol 时,在上述条件下重新达平衡时,生成CO和水蒸气物质的量之和可能为( )
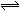 CO + H2O,已知达平衡时生成0.75 mol CO,则当H2 改为9 mol 时,在上述条件下重新达平衡时,生成CO和水蒸气物质的量之和可能为( )
CO + H2O,已知达平衡时生成0.75 mol CO,则当H2 改为9 mol 时,在上述条件下重新达平衡时,生成CO和水蒸气物质的量之和可能为( )| A.2.0mol | B.1.5mol | C.1.8mol | D.2.5mol |
C
达平衡时生成0.75 mol CO,根据方程式可知同时生成水蒸气也是0.75mol。增大氢气浓度,则提高CO2的转化率,但反应是可逆反应,所以平衡时CO和水蒸气的物质的量不可能达到1mol,因此正确的答案选C。

练习册系列答案
相关题目
 2Z(g)反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Y的体积分数。下列叙述正确的是( )
2Z(g)反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Y的体积分数。下列叙述正确的是( )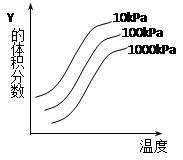
 2C(g);△H<0。若起始时,M、N容积相同。下列说法正确的是( )
2C(g);△H<0。若起始时,M、N容积相同。下列说法正确的是( )
 CO2(g)+ H2(g) ;△H<0。在850℃时,平衡常数K=1。
CO2(g)+ H2(g) ;△H<0。在850℃时,平衡常数K=1。 2AB(g),达到平衡的标志的是( )
2AB(g),达到平衡的标志的是( ) 2SO3。请填写下列空白:
2SO3。请填写下列空白: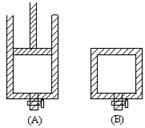
 Z(g) ⊿H>0。经60s达到平衡,生成0.3mol Z。下列说法正确的是
Z(g) ⊿H>0。经60s达到平衡,生成0.3mol Z。下列说法正确的是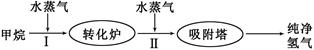
 H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如下表: