题目内容
(每空2分,共14分)在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
(1)t1= s,在答题卷的方框内画一幅以时间对温度的曲线图(纵轴表示时间,横轴表示温度)。
(2)利用所画的曲线图,关于温度影响反应速率的结论是 。
(3)t1 (填“>”或“<”)t4,原因是 。t2 t3(填“>”或“<”),原因是 。
| | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于水的时间/s |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | t1 |
| E | 2 | 颗粒 | 15 | t2 |
| F | 2 | 粉末 | 15 | t3 |
| G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(2)利用所画的曲线图,关于温度影响反应速率的结论是 。
(3)t1 (填“>”或“<”)t4,原因是 。t2 t3(填“>”或“<”),原因是 。
(每空2分,共14分)(1) 50 ,
(2) 对于该溶液,温度每升高10℃,反应速率加快到原来的2倍 。
(3) > , G组中可形成Cu-Zn原电池,反应速率加快 。
> , F组中锌为粉末状,表面积较大,反应速率较快

(2) 对于该溶液,温度每升高10℃,反应速率加快到原来的2倍 。
(3) > , G组中可形成Cu-Zn原电池,反应速率加快 。
> , F组中锌为粉末状,表面积较大,反应速率较快
(1)根据表中ABCD数据可知,温度每升高10℃,反应速率加快到原来的2倍,所以t1=100s÷2=5s。
(2)根据表中数据和图像可知,温度每升高10℃,反应速率加快到原来的2倍。
(3)实验G中含有杂质铜,所以能构成原电池,加快反应速率,因此时间少,即t1大于t4。又因为反应物的接触面积越大,反应速率越大,所以根据EF可知t2大于t3。
(2)根据表中数据和图像可知,温度每升高10℃,反应速率加快到原来的2倍。
(3)实验G中含有杂质铜,所以能构成原电池,加快反应速率,因此时间少,即t1大于t4。又因为反应物的接触面积越大,反应速率越大,所以根据EF可知t2大于t3。

练习册系列答案
相关题目
 C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是 C(g)
C(g) 2C(g) △H>0,达到平衡后,将反应混合物温度降低,下列叙述中,正确的
2C(g) △H>0,达到平衡后,将反应混合物温度降低,下列叙述中,正确的 CO(g)+H2(g) △H=+131.3KJ.mol-1[各容器中C(s)均足量],在某时刻测得有关物质的浓度及正、逆反应速率的关系如下表。下列说法不正确的是
CO(g)+H2(g) △H=+131.3KJ.mol-1[各容器中C(s)均足量],在某时刻测得有关物质的浓度及正、逆反应速率的关系如下表。下列说法不正确的是 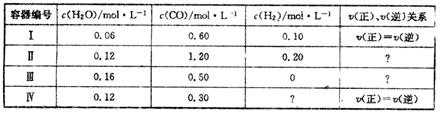

 2M
2M CO + H2O,已知达平衡时生成0.75 mol CO,则当H2 改为9 mol 时,在上述条件下重新达平衡时,生成CO和水蒸气物质的量之和可能为( )
CO + H2O,已知达平衡时生成0.75 mol CO,则当H2 改为9 mol 时,在上述条件下重新达平衡时,生成CO和水蒸气物质的量之和可能为( ) H+ +Cl- + HClO达到平衡后,要HClO浓度增大,可加入( )
H+ +Cl- + HClO达到平衡后,要HClO浓度增大,可加入( )