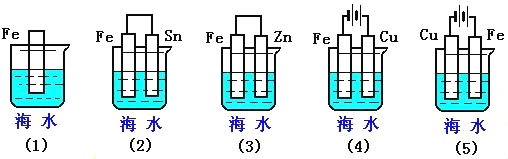
题目内容
【题目】金属镍在电池、合金、催化剂等方面应用广泛.
(1)下列关于金属及金属键的说法正确的是 .
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是 .
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n= .CO与N2结构相似,CO分子内σ键与π键个数之比为 .
(4)甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH).甲醇分子内C原子的杂化方式为 ,甲醇分子内的O﹣C﹣H键角 (填“大于”“等于”或“小于”)甲醛分子内的O﹣C﹣H键角.
【答案】(1)b;(2)C;(3)4;1:2;(4)sp3;小于.
【解析】试题分析:(1)金属键没有方向性和饱和性,金属键是金属阳离子和自由电子间的相互作用,金属导电是因为自由电子在外加电场作用下发生定向移动,属具有光泽是因为自由电子能够吸收可见光;
(2)Ni的外围电子排布为3d84s2,3d能级上有2个未成对电子;
(3)CO配位时,提供碳原子上的一对孤对电子;CO中C和O以三键结合;
(4)ABm型杂化类型的判断:
中心原子电子对计算公式:电子对数n=![]() (中心原子的价电子数+配位原子的成键电子数±电荷数)
(中心原子的价电子数+配位原子的成键电子数±电荷数)
注意:①当上述公式中电荷数为正值时取“﹣”,电荷数为负值时取“+”.
②当配位原子为氧原子或硫原子时,成键电子数为零.
根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化;sp3杂化是四面体构型,sp2杂化,分子呈平面三角形.
解:(1)a.金属键没有方向性和饱和性,故A错误;
b.金属键是金属阳离子和自由电子间的相互作用,故B正确;
c.金属导电是因为自由电子在外加电场作用下发生定向移动,故C错误;
d.金属具有光泽是因为自由电子能够吸收可见光,故D错误,
故答案为:b;
(2)Ni的外围电子排布为3d84s2,3d能级上有2个未成对电子.第二周期中未成对电子数为2的元素有C、O,其中C的电负性小,
故答案为:C;
(3)中心原子价电子数与配体提供电子总数之和为18,中心原子是Ni,价电子排布3d84s2,共10个电子,CO配位时,提供碳原子上的一对孤对电子,![]() =4;CO中C和O以三键结合,含有1个σ键、2个π键,故答案为:4;1:2;
=4;CO中C和O以三键结合,含有1个σ键、2个π键,故答案为:4;1:2;
(4)甲醇分子内C的成键电子对数为4,无孤电子对,杂化类型为sp3,是四面体结构,甲醛分子中的碳采取sp2杂化,是平面三角形结构,甲醇分子内O﹣C﹣H键角比甲醛分子内O﹣C﹣H键角小,故答案为:sp3;小于.

 新思维寒假作业系列答案
新思维寒假作业系列答案