题目内容
6.实验室用50mL浓盐酸跟足量的氯酸钾固体共热制取氯气,反应的化学方程式为:KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ KCl+3Cl2↑+3H2O.(只第(3)题写计算过程)(1)浓盐酸在反应中显示出来的性质是②(填写编号).
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)若产生0.1mol Cl2,则转移电子的物质的量为$\frac{1}{6}$mol.
(3)若反应中HCl的利用率只有50%,当反应结束时,生成Cl20.15mol,求浓盐酸的物质的量浓度.(写计算过程)
分析 (1)HCl中Cl元素的化合价由-1价升高0,则HCl具有还原性,又生成盐KCl,则表现酸的酸性;
(2)根据氯气物质的量计算KClO3的物质的量,KClO3中Cl元素的化合价由+5价降低0,据此计算转移电子;
(3)根据氯气物质的量计算参加反应HCl的物质的量,再根据HCl利用率计算盐酸中HCl总物质的量,根据c=$\frac{n}{V}$计算盐酸物质的量浓度.
解答 解:(1)在反应KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ KCl+3Cl2↑+3H2O中,HCl中Cl元素的化合价由-1价升高0,则HCl具有还原性,又生成盐KCl,则表现酸的酸性,
故答案为:②;
(2)产生0.1mol Cl2,根据KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ KCl+3Cl2↑+3H2O,可知反应的KClO3的物质的量为$\frac{0.1mol}{3}$,KClO3中Cl元素的化合价由+5价降低0,转移电子物质的量为$\frac{0.1mol}{3}$×5=$\frac{1}{6}$mol,
故答案为:$\frac{1}{6}$;
(3)生成Cl20.15mol,根据KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ KCl+3Cl2↑+3H2O,可知反应的HCl的物质的量为0.15mol×$\frac{6}{3}$=0.3mol,HCl的利用率只有50%,则盐酸中HCl总物质的量为$\frac{0.3mol}{50%}$=0.6mol,故盐酸物质的量浓度为$\frac{0.6mol}{0.05L}$=12mol/L,
答:浓盐酸的物质的量浓度为12mol/L.
点评 本题考查氧化还原反应、化学方程式有关计算,比较基础,侧重对基础知识的巩固.

| A. | 根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物和两性氧化物等 | |
| B. | 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据是否有丁达尔现象将分散系分为溶液、胶体和浊液 | |
| D. | 根据组成元素的种类将纯净物分为单质和化合物 |
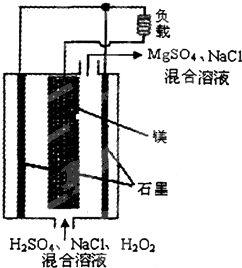 镁-过氧化氢燃料电池具有比能量高、安全方便等优点,其结构示意如图所示.关于该电池的叙述正确的是( )
镁-过氧化氢燃料电池具有比能量高、安全方便等优点,其结构示意如图所示.关于该电池的叙述正确的是( )| A. | 电池工作时,H+向正极移动 | |
| B. | 该电池可以在高温下正常工作 | |
| C. | 电池工作时,正极周围溶液的pH将不断变小 | |
| D. | 该电池的总反应式为:Mg+H2O2+H2SO4═MgSO4+2H2O |
| A. | 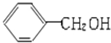 与 与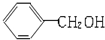 互为同系物 互为同系物 | B. | 乙醇和二甲醚互为同分异构体 | ||
| C. | 乙醇、乙二醇、丙三醇互为同系物 | D. | 可用浓溴水来区分乙醇和苯酚 |
| A. | 100 mL 0.5 mol/L MgCl2溶液 | B. | 200 mL 0.25 mol/L AlCl3溶液 | ||
| C. | 50 mL 1mol/L NaCl溶液 | D. | 25 mL 0.5 mol/L HCl溶液 |
| A. | 次氯酸分子的电子式: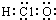 | B. | CH4Si的结构式: | ||
| C. | HCN分子的结构式:H-C≡N | D. | 丙烷分子的比例模型: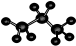 |
| ① | ② | ③ | ④ | |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
| A. | ②、④两溶液相比,两者的kw相同 | |
| B. | 四种溶液分别加水稀释10倍,pH变化最大的是①和④ | |
| C. | ①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小 | |
| D. | ①、④两溶液按一定体积比混合,所得溶液中离子浓度顺序一定为:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| A. | (3)最少 | B. | (3)最多 | C. | 都一样多 | D. | 无法确定 |
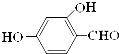 原儿茶醛是制造医药及染料的中间体,可用于制造多种抗菌素和消炎药物.其结构如图:请回答:
原儿茶醛是制造医药及染料的中间体,可用于制造多种抗菌素和消炎药物.其结构如图:请回答: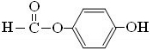 .
.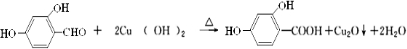 .
.