题目内容
【题目】16.8gFe跟一定量浓 HNO3 反应,Fe 全部溶解,共收集NO、NO2的总体积为 11.2 L(标准状况),所得溶液中 H+的物质的量为0.02mol,请回答:
(1)反应中被还原的硝酸为_______mol。
(2)生成的 NO 与 NO2 的物质的量之比为______。
(3)写出该反应的离子方程式:______。
【答案】0.5 2:3 3Fe +14H++5NO3 -===3Fe3++2NO2↑+3NO↑+7H2O
【解析】
16.8gFe跟一定量浓 HNO3 反应,Fe 全部溶解,所得溶液中 H+的物质的量为0.02mol,说明硝酸有剩余,铁全部被氧化物Fe3+;硝酸被还原为NO、NO2;根据得失电子守恒计算NO 与 NO2 的物质的量之比。
(1)硝酸被还原为NO、NO2,根据氮元素守恒,被还原的硝酸的物质的量等于NO、NO2的物质的量,所以被还原的硝酸的物质的量=![]() 0.5mol;
0.5mol;
(2)设生成的 NO的物质的量是 xmol,则NO2 的物质的量(0.5-x) mol;根据得失电子守恒![]() ,x=0.2mol,所以NO、NO2的物质的量分别是0.2mol、0.3mol,生成的 NO 与 NO2 的物质的量之比为2:3;
,x=0.2mol,所以NO、NO2的物质的量分别是0.2mol、0.3mol,生成的 NO 与 NO2 的物质的量之比为2:3;
(3)生成的 NO 与 NO2 的物质的量之比为2:3,根据得失电子守恒配平方程式,该反应的离子方程式是3Fe +14H++5NO3 -===3Fe3++2NO2↑+3NO↑+7H2O。

【题目】硝酸是氧化性酸,其本质是NO3-有氧化性,某课外实验小组进行了下列有关NO3-氧化性的探究(实验均在通风橱中完成)。
实验装置 | 编号 | 溶液X | 实验现象 |
| 实验Ⅰ | 6 mol·L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色。 |
实验Ⅱ | 15 mol·L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色。 |
(1)实验Ⅰ中,铝片作_____(填“正”或“负”)极。液面上方产生红棕色气体的化学方程式是_________。
(2)实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是____________________。
查阅资料:活泼金属与1 mol·L-1稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原。
(3)用上图装置进行实验Ⅲ:溶液X为1 mol·L-1稀硝酸溶液,观察到电流计指针向 右偏转。
①反应后的溶液中含NH4+。实验室检验NH4+的方法是______________________________。
②生成NH4+的电极反应式是_____________________________________________。
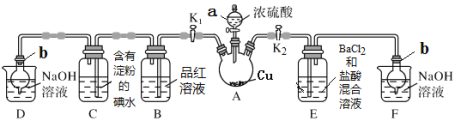
(4)进一步探究碱性条件下NO3-的氧化性,进行实验Ⅳ:

①观察到A中有NH3生成,B中无明显现象。A、B产生不同现象的解释是_______________。
②A中生成NH3的离子方程式是_______________________________。
(5)将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由_________________。