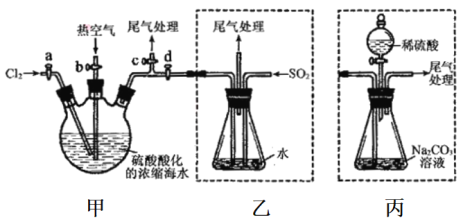
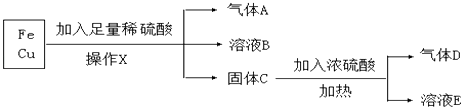
题目内容
【题目】下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫磺分别完全燃烧,二者放出的热量一样多
B.氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJ/mol
C.2H2(g)+O2(g)═2H2O(l)△H=﹣Q1 kJ/mol 2H2(g)+O2(g)═2H2O(g)△H=﹣Q2 kJ/mol,则Q1>Q2
D.已知中和热为57.3 kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量等于57.3kJ
【答案】C
【解析】解:A.硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,故A错误;
B.在101kpa时,2gH2完全燃烧,生成液态水,放出285.8KJ热量,则氢气燃烧的热化学方程式表示为:H2(g)+ ![]() O2(g)═H2O(l)△H=﹣285.8KJ/mol,故B错误;
O2(g)═H2O(l)△H=﹣285.8KJ/mol,故B错误;
C.H2O(g)→H2O(l)为放热过程,2molH2(g)和1mol O2(g)反应生成2mol H2O(l)时放出的热量多,即Q1>Q2,故C正确;
D.浓硫酸稀释过程中放出热量,所以放出的热量大于57.3kJ,故D错误;
故选C.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热.

【题目】化学学习小组进行如下实验.
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化).限选试剂和仪器:0.20mol/LH2C2O4溶液、0.010mol/LKMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 | V(0.20mol/H2 | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 50 | |
② | 2.0 | 0 | 4.0 | 25 | |
③ | 1.0 | a | 4.0 | 25 |
(1)上述实验①②是探究对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为;乙是实验需要测量的物理量,则表 格中“乙”应填写 .
(2)【测定 H2C2O4xH2O 中 x 值】已知:M(H2C2O4)=90g/mol
①称取 1.260g 纯草酸晶体,将其酸制成 100.00mL 水溶液为待测液.
②取 25.00mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000molL﹣1 的 KMnO 标准溶液进行滴定;
请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如图1,最合理的是(选填 a、b).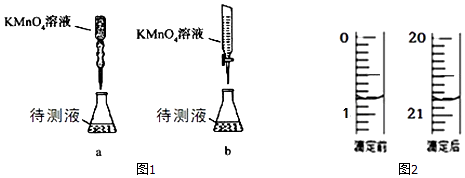
(4)由图2可知消耗 KMnO4溶液体积为mL;
(5)滴定过程中眼睛应注视;
(6)通过上述数据,求得 x= . 以标准 KMnO4溶液滴定样品溶液的浓度,未用标准 KMnO4溶液润洗滴定管,引起实验结果(偏大、偏小或没有影响).