题目内容
【题目】硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O] 俗称莫尔盐,可溶于水,在100℃~110℃时分解。在定量分析中常用作标定重铬酸钾、高锰酸钾等溶液的标准物质,还用于冶金、电镀等。
Ⅰ.化学课外活动小组研究莫尔盐晶体强热时的分解产物。
(1)甲组同学按照如图所示的装置进行研究,装置C中可观察到的现象是__________,由此可知分解产物中有____________。
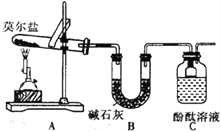
(2)乙组同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2。为进行验证,选用甲组实验中的装置A和下图所示的部分装置进行实验。
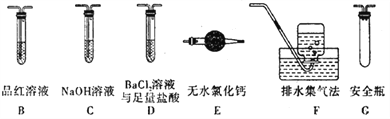
①乙组同学的实验中,装置依次连接的合理顺序为A、____________。
②含有SO3的实验现象是______________;
Ⅱ.为测硫酸亚铁铵纯度,称取m g莫尔盐样品,配成500mL溶液。甲、乙、丙三位同学设计了如下三个实验方案,请回答:
甲方案:取25.00mL硫酸亚铁铵溶液用0.1000mol·L-1的酸性KMnO4溶液分三次进行滴定。
乙方案:取25.00 mL硫酸亚铁铵溶液进行如下实验。
![]()
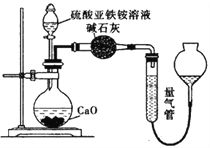
丙方案:(通过![]() 测定)实验设计图如下所示。取25.00mL硫酸亚铁铵溶液进行该实验。
测定)实验设计图如下所示。取25.00mL硫酸亚铁铵溶液进行该实验。
(1)甲方案中的离子方程式为___________,若实验操作都正确,但其测定结果总是小于乙方案,可能原因为___________。
(2)乙方案中沉淀是否洗涤干净的检验方法是________________。
(3)丙方案中量气管中最佳试剂是______________。
a.水 b.饱和NaHCO3溶液 c.CCl4
(4)若测得NH3(已折算为标准状况下)为V L,则硫酸亚铁铵纯度为_____________。
【答案】 溶液变红 NH3 G D B C F D中出现白色沉淀 MnO4- + 5Fe2+ 8H+ = Mn2+ + 5Fe3+ + 4H2O Fe2+已被空气部分氧化 取最后一次洗涤的滤液加入AgNO3溶液,若没有沉淀,说明已洗干净 c 175V/m或![]()
【解析】Ⅰ.(1)莫尔盐硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O] 受热分解,分解产生氨气和二氧化硫、三氧化硫等酸性气体,由装置图,碱石灰可以吸收酸性气体,氨气遇到酚酞溶液变红色,装置C中可观察到的现象是溶液变红,可知莫尔盐晶体分解的产物中有 NH3;(2)①要检验生成SO3(g)、SO2(g)及N2,在甲组实验中的装置A产生气体后,经过安全瓶后通过氯化钡溶液检验SO3,再通过品红溶液检验SO2,用浓氢氧化钠除去二氧化硫,用排水集气法收集氮气,所以装置依次连接的合理顺序为A、G、D、B、C、F;②由于产生的气体中有氨气,所以氯化钡溶液中加入足量的盐酸,可以吸收氨气并防止产生亚硫酸钡沉淀,排除SO2的干扰,SO3通入氯化钡溶液中可以产生硫酸钡沉淀,二氧化硫能使品红褪色,含有SO3的实验现象是:D中有白色沉淀;Ⅱ.(1)高锰酸钾溶液具有氧化性,能氧化亚铁离子为铁离子,反应离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,亚铁离子具有还原性,易被空气中的氧气氧化成铁离子;(2)乙方案中沉淀是否洗涤干净,可以设计实验检验洗涤液中是否含有氯离子检验沉淀洗涤是否干净,具体步骤为:取最后一次洗涤的滤液加入AgNO3溶液,若没有沉淀,说明已洗干净;(3)丙方案中,量气管中液体应不能溶解氨气,氨气易溶于水和饱和碳酸钠溶液,难溶于四氯化碳,故用排四氯化碳法收集,故选c;
(4)VL氨气的物质的量为:![]() =
=![]() mol,m g硫酸亚铁铵样品中含N的物质的量为
mol,m g硫酸亚铁铵样品中含N的物质的量为![]() ×
×![]() mol=
mol=![]() mol,硫酸亚铁铵的纯度为:
mol,硫酸亚铁铵的纯度为:![]() ×100%=
×100%=![]() ×100%。
×100%。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案