��Ŀ����
����Ŀ������ΪԪ�����ڱ��е�һ���֣��û�ѧʽ��Ԫ�ط��Żش��������⣺
| ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
�� | �� | �� | �� | |||||
�� | �� | �� | �� | �� | �� | |||
�� | �� | �� |
��1���������γ��������������Ԫ������дԪ�����ƣ�����Ԫ����Ԫ�����ڱ��е�λ���� �� д����Ԫ�ض�Ӧ���������������Ʒ�Ӧ�Ļ�ѧ����ʽ ��
��2���٢ڢ��У�����������Ӧ��ˮ���������ǿ���� �� ��д��ѧʽ�� �����Ӧ����̬�⻯����ȶ��ԴӴ�С��˳���� �� ���û�ѧʽ��ʾ��
��3��Ԫ�آߵ��⻯�����ʽΪ �� ���⻯��������ۺ����ᷴӦ���ɵĻ������к��еĻ�ѧ�������� �� �������������ӡ����ۡ���
��4���ж�Ԫ�آܺ͢��Ӧ�ij������������Ե�ǿ�����û�ѧʽ��ʾ�������û�ѧ����ʽ��������жϣ� ��
���𰸡�
��1�������������ڵڢ�A�壻NaOH+Al��OH��3�TNaAlO2+2H2O
��2��KOH��HF��HCl��HBr
��3��![]() �����Ӽ������ۼ�������
�����Ӽ������ۼ�������
��4��Cl2��S��Na2S+Cl2=2NaCl+S
���������⣺��Ԫ����Ԫ�����ڱ��е�λ�ÿ�֪����ΪNa����ΪK����ΪMg����ΪS����ΪAl����ΪC����ΪN����ΪCl����ΪBr����ΪF��ΪAr����1�����γ��������������Ԫ��Ϊ�����������ڱ��е������ڵڢ�A�壻��Ԫ�ص�����������Ӧ��ˮ����ΪAl��OH��3 �� ��NaOH��Ӧ����ƫ��������ˮ����Ӧ����ʽΪ��NaOH+Al��OH��3�TNaAlO2+2H2O�� ���Դ��ǣ������������ڵڢ�A�壻NaOH+Al��OH��3�TNaAlO2+2H2O����2����������ǿ��ΪK������������Ӧ��ˮ���������ǿ��Ԫ����K��������������Ӧ��ˮ����ΪKOH���ǽ�������ǿ��Ԫ��ΪF�����ΪCl��������ΪBr�����Ӧ����̬�⻯����ȶ��ԴӴ�С��˳����HF��HCl��HBr��
���Դ��ǣ�KOH��HF��HCl��HBr����3�������ĵ���ʽΪ ![]() ������������ۺ����ᷴӦ���ɵĻ�����Ϊ����泥��������笠���������������Ӽ��γ����Ӽ����������ӻ����笠���������������Ӿ��ɹ��ۼ��γɣ�
������������ۺ����ᷴӦ���ɵĻ�����Ϊ����泥��������笠���������������Ӽ��γ����Ӽ����������ӻ����笠���������������Ӿ��ɹ��ۼ��γɣ�
���Դ��ǣ� ![]() �����Ӽ������ۼ������ӣ���4��Ԫ�آܺ͢��Ӧ�ij������ʷֱ�ΪS��Cl2 �� S������������Cl2�ģ����������Ʒ�Ӧ�����Ȼ���������˵�������������Ը�ǿ���÷�Ӧ����ʽΪNa2S+Cl2=2NaCl+S�����Դ��ǣ�Cl2��S��Na2S+Cl2=2NaCl+S��
�����Ӽ������ۼ������ӣ���4��Ԫ�آܺ͢��Ӧ�ij������ʷֱ�ΪS��Cl2 �� S������������Cl2�ģ����������Ʒ�Ӧ�����Ȼ���������˵�������������Ը�ǿ���÷�Ӧ����ʽΪNa2S+Cl2=2NaCl+S�����Դ��ǣ�Cl2��S��Na2S+Cl2=2NaCl+S��

 ��У���һ��ͨϵ�д�
��У���һ��ͨϵ�д� �γ̴����Ծ�����100��ϵ�д�
�γ̴����Ծ�����100��ϵ�д� �¾�����ĩ���100��ϵ�д�
�¾�����ĩ���100��ϵ�д� ȫ�ܴ���100��ϵ�д�
ȫ�ܴ���100��ϵ�д�����Ŀ��ijѧϰС��ͨ�������ʵ��һ��ʵ�����̽��ijЩ��ѧ���ۣ�
��1��ʵ��һ���Է�Ӧ2Fe3++2I��=2Fe2++I2Ϊ���� ̽���÷�Ӧ�Ƿ�Ϊ���淴Ӧ��
ʵ�鷽������KI��Һ�еμ�3mLFeCl3��Һ�������Һ��
�ȷֵ��ס��ҡ�����֧�Թ��У����Թܼ��еμӵ���
��Һ�����Թ����еμ�KSCN��Һ����ͼ��ʾ��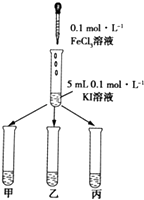
���Թܼ��г�������
���Թ��г�������
��˵���÷�ӦΪ���淴Ӧ��
��2��ʵ�����ʵ�����Ʊ�CO2�ķ�Ӧ��ʵ������е����ݼ������Ϣ���±���
��� | ��Ӧ�¶�/�� | C��HCl��/molL��1 | V��HCl��/mL | 10g̼��Ƶ���״ | t/min |
�� | 20 | 2 | 10 | ��״ | t 1 |
�� | 20 | 4 | 10 | ��״ | t 2 |
�� | 20 | 2 | 10 | ��ĩ | t 3 |
�� | 40 | 2 | 10 | ��ĩ | t 4 |
�� | 40 | 4 | 10 | ��ĩ | t5 |
��t��ʾ�ռ���ͬ״���������Ϊa mL CO2�����ʱ���
��i���ɱ����е���Ϣ��֪ʵ�����Ŀ����̽��
��ii��ʵ��ٺ�ʵ�����̽���Ըû�ѧ��Ӧ���ʵ�Ӱ�죬���������е���Ϣ��֪���Ըû�ѧ��Ӧ���ʵ�Ӱ�����ػ���
��iii���ռ�a mL CO2�����ʱ�����ٵ�ʵ��������ʵ����ţ�