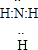题目内容
下列叙述正确的是
- A.1 mol任何物质都含有6.02×1023个原子
- B.0.012 kg12C约含有6.02×1023个碳原子
- C.硫酸的摩尔质量是98g
- D.常温常压下,1 mol氧气的体积约为22.4L
B
分析:A、物质有的是单原子分子,有的是双原子分子多原子分子,离子化合物等;
B、依据阿伏伽德罗常数的概念分析判断;
C、摩尔质量是单位物质的量的物质的质量;
D、常温常压下,气体摩尔体积不为22.4L/mol.
解答:A、构成物质的微粒不同,1 mol任何物质不一定都含有6.02×1023个原子,故A错误;
B、0.012 kg12C约含有6.02×1023个碳原子为1mol,为阿伏伽德罗常数的规定,故B正确;
C、硫酸的摩尔质量是98g/mol,故C错误;
D、常温常压下,1 mol氧气的体积不是22.4L,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要考查阿伏伽德罗常数的规定,气体摩尔体积的条件应用,摩尔质量的概念判断,题目较简单.
分析:A、物质有的是单原子分子,有的是双原子分子多原子分子,离子化合物等;
B、依据阿伏伽德罗常数的概念分析判断;
C、摩尔质量是单位物质的量的物质的质量;
D、常温常压下,气体摩尔体积不为22.4L/mol.
解答:A、构成物质的微粒不同,1 mol任何物质不一定都含有6.02×1023个原子,故A错误;
B、0.012 kg12C约含有6.02×1023个碳原子为1mol,为阿伏伽德罗常数的规定,故B正确;
C、硫酸的摩尔质量是98g/mol,故C错误;
D、常温常压下,1 mol氧气的体积不是22.4L,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要考查阿伏伽德罗常数的规定,气体摩尔体积的条件应用,摩尔质量的概念判断,题目较简单.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目
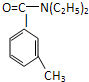 避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH
避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH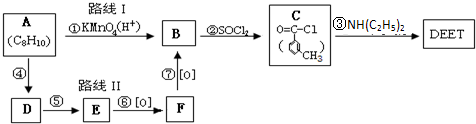


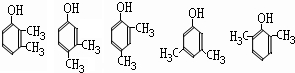 (任写2种)
(任写2种)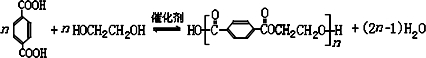

 NH3?H2O+H+
NH3?H2O+H+ (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.