题目内容
【题目】肼![]() 是一种无色、易溶于水的液体,沸点为
是一种无色、易溶于水的液体,沸点为![]() 。具有强还原性,长期暴露在空气中或短时间受高温作用会爆炸分解。广泛应用于医药等领域。实验室中用尿素法生产肼,并用
。具有强还原性,长期暴露在空气中或短时间受高温作用会爆炸分解。广泛应用于医药等领域。实验室中用尿素法生产肼,并用![]() 吸收制备硫酸肼
吸收制备硫酸肼![]() 的装置如下:
的装置如下:
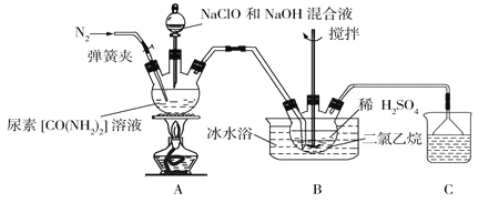
已知:①硫酸肼又称为“硫酸联氨”,是一种白色固体,微溶于冷水,易溶于热水,不溶于乙醇和二氯乙烷等有机溶剂,是一种类似于![]() 的盐类,有还原性。
的盐类,有还原性。
②密度:![]() 硫酸肼
硫酸肼![]() 二氯乙烷
二氯乙烷![]() 稀硫酸
稀硫酸![]() 。
。
回答下列问题:
(1)盛装尿素溶液的装置名称为__________________。
(2)反应前应先通入一段时间的氮气,其目的为________________________________。
(3)装置A中发生反应制备肼的离子方程式为__________________________________。
(4)反应过程中,如果分液漏斗中溶液滴速过快,会导致硫酸肼的产率偏低,其原因是_________。
(5)装置B中二氯乙烷的作用为_______________,使用冰水浴的作用为______________。
(6)装置B反应完全后需经过过滤、洗涤、干燥等操作得到硫酸肼,洗涤过程中最好选择下列哪种洗涤剂____________![]() 填字母
填字母![]() 。
。
A.冷水 ![]() 热水
热水 ![]() 无水乙醇
无水乙醇 ![]() 饱和食盐水
饱和食盐水
(7)硫酸肼还原![]() 制银的方法既实现了废旧电池中Ag的回收利用,又不会对环境产生污染。理论上,
制银的方法既实现了废旧电池中Ag的回收利用,又不会对环境产生污染。理论上,![]() 硫酸肼可制得 ___________
硫酸肼可制得 ___________![]() 。
。
【答案】三颈烧瓶 赶走装置中的空气,避免空气与肼反应 ![]() 生成的肼被过量的次氯酸钠氧化,导致硫酸肼产率降低 防倒吸,同时使产物硫酸肼从反应混合液析出 利于产物析出,同时降温防爆炸
生成的肼被过量的次氯酸钠氧化,导致硫酸肼产率降低 防倒吸,同时使产物硫酸肼从反应混合液析出 利于产物析出,同时降温防爆炸 ![]()
![]()
【解析】
(1)盛装尿素溶液的装置名称为三颈烧瓶;
(2)肼![]() 是一种无色、易溶于水的液体,沸点为
是一种无色、易溶于水的液体,沸点为![]() 。具有强还原性,长期暴露在空气中或短时间受高温作用会爆炸分解,所以反应前应先通入一段时间氮气,其目的为排尽装置内的空气,防止空气与肼反应;
。具有强还原性,长期暴露在空气中或短时间受高温作用会爆炸分解,所以反应前应先通入一段时间氮气,其目的为排尽装置内的空气,防止空气与肼反应;
(3)装置A中,在碱性溶液中,ClO-将尿素氧化为肼,自身被还原为Cl-,发生氧化还原反应;
(4)如果分液漏斗中溶液滴速过快,会使过量的次氯酸钠氧化生成的肼;
(5)肼进入装置B中,由于二氯乙烷密度大于稀硫酸,所以二氯乙烷在稀硫酸的下层,肼直接通入二氯乙烷中,可以防止倒吸,同时硫酸肼不溶于二氯乙烷,可以使硫酸肼从反应混合液析出。二氯乙烷中通入肼后,肼逸出,在上层与稀硫酸反应生成硫酸肼,硫酸肼微溶于冷水,易溶于热水,冰水浴是为了降低产物的溶解性,同时降温防爆炸;
(6)洗涤过程中尽可能减少产品的溶解损失,由于硫酸肼不溶于乙醇,可选择无水乙醇;
(7)硫酸肼还原![]() 制银,利用得失电子守恒计算;
制银,利用得失电子守恒计算;
(1)盛装尿素溶液的装置名称为三颈烧瓶,故答案为:三颈烧瓶;
(2)反应前应先通入一段时间氮气,其目的为排尽装置内的空气,防止空气与强还原性的肼反应,故答案为:赶走装置中的空气,避免空气与肼反应;
(3)装置A中,在碱性溶液中,ClO-将尿素氧化为肼,自身被还原为Cl-,发生氧化还原反应:![]() ,
,
故答案为:![]() ;
;
(4)肼具有还原性,如果分液漏斗中溶液滴速过快,会使过量的次氯酸钠氧化生成的肼,故答案为:生成的肼被过量的次氯酸钠氧化,导致硫酸肼产率降低;
(5)装置B中二氯乙烷的作用为防倒吸,同时使产物硫酸肼脱离反应混合液,使用冰水浴的作用为减低产物的溶解度,同时降温防爆,故答案为:防倒吸;同时使产物硫酸肼从反应混合液析出,利于产物析出,同时降温防爆炸;
(6)装置B反应完全后经过滤,洗涤,干燥等操作得到硫酸肼,洗涤过程中尽可能减少产品的溶解损失,所以最好选择无水乙醇,故答案为C;
(7)硫酸肼还原![]() 制银,硫酸肼是还原剂,氧化银是氧化剂,银是还原产物,得到的物质无污染,故N2是氧化产物,1molN2H4·H2SO4中的+2价氮化合价升高为0价,失去4mol电子, Ag2O中的+1价银化合价降低到0价,生成1molAg得到1mol电子,根据电子守恒有:
制银,硫酸肼是还原剂,氧化银是氧化剂,银是还原产物,得到的物质无污染,故N2是氧化产物,1molN2H4·H2SO4中的+2价氮化合价升高为0价,失去4mol电子, Ag2O中的+1价银化合价降低到0价,生成1molAg得到1mol电子,根据电子守恒有:![]() =3323g;故答案为:3323;
=3323g;故答案为:3323;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案