题目内容
【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
i.水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g)△H1
H2S(g)+CO2(g)△H1
ⅱ.氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H2
H2S(g)+CO(g) △H2
已知反应中相关的化学键键能数据如下表:
化学键 | H-H | C=O(COS) | C=S | H-S | C |
E/kJ·mol-1 | 436 | 745 | 580 | 339 | 1076 |
①一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(a)与温度(T)的关系如图(a)所示。则A、B、C三点对应的化学反应速率大小顺序为_________(填标号)。

②结合上表中数据,计算反应ⅱ的△H2为___________。
③反应ⅱ的正、逆反应的平衡常数(K)与温度(T)的关系如上图(b)所示,其中表示逆反应的平衡常数(K)的曲线是_______________(填“A”或“B”)。T1℃时,向容积为2L的恒容密闭容器中充入2 mol COS(g)和1molH2(g),发生反应ⅱ,COS的平衡转化率为__________________。
(2)过二硫酸是一种强氧化性酸,其结构式如下所示,
 ,在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为______。
,在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为______。
(3)NaHS可用于污水处理的沉淀剂。
已知:25℃时,反应Hg2+(aq)+HS-(aq)![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。则Ksp(HgS)=__________。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。则Ksp(HgS)=__________。
(4)降低SO2的排放量已经写入2018年政府工作报告,某种电化学脱硫法装置如下图所示,不仅可脱除烟气中的SO2,还可以制得H2SO4。在阴极放电的物质是_____________,在阳极生成SO3的电极反应式是__________________。
 。
。
【答案】vA<vB<vC+7kJ/molB33.3%5S2O82-+2Mn2++8H2O![]() 10SO42-+2MnO4-+16H+4.0×10-53O2SO2-2e-+SO42-=2SO3
10SO42-+2MnO4-+16H+4.0×10-53O2SO2-2e-+SO42-=2SO3
【解析】
(1) ①化学反应速率大小与转化率大小无关,与是否处于平衡状态也无关,从图像可知,A、B、C三点对应的温度不同,温度越高化学反应速率越大,因为温度A<B<C,所以反应速率vA<vB<vC,
故答案为:vA<vB<vC;
②反应ii COS(g)+H2(g)![]() H2S(g)+CO(g)△H2=反应物的键能之和-生成物的键能之和=745 kJ/mol +580 kJ/mol +436 kJ/mol -339 kJ/mol×2-1076 kJ/mol =+7kJ/mol,
H2S(g)+CO(g)△H2=反应物的键能之和-生成物的键能之和=745 kJ/mol +580 kJ/mol +436 kJ/mol -339 kJ/mol×2-1076 kJ/mol =+7kJ/mol,
故答案为:+7kJ/mol;
③由②的结果可知,反应ii COS(g)+H2(g)![]() H2S(g)+CO(g)的正反应为吸热反应,升高温度,平衡正向移动,平衡常数增大,对应曲线A,因此对应逆反应的平衡常数(K逆)的是B;
H2S(g)+CO(g)的正反应为吸热反应,升高温度,平衡正向移动,平衡常数增大,对应曲线A,因此对应逆反应的平衡常数(K逆)的是B;
根据图像,T1℃时,K逆= K正=1,
COS(g)+H2(g)![]() H2S(g)+CO(g)
H2S(g)+CO(g)
起始(mol) 2 1 0 0
反应(mol)x x x x
平衡(mol) 2-x 1-x x x
则K=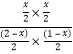 =1,解得x=
=1,解得x=![]() ,COS的平衡转化率=
,COS的平衡转化率=![]() ×100%= 33.3%,
×100%= 33.3%,
故答案为:B;33.3%;
(2)Mn由+2价升到+7价,S2O82-中有两个-1价的氧降到-2价,根据得失电子守恒配平反应,再由电荷守恒确定出产物中有H+,最后由H原子守恒,确定反应物中还有H2O,并配平,得到离子方程式为:5S2O82-+2Mn2++8H2O![]() 10SO42-+2MnO4-+16H+ ,
10SO42-+2MnO4-+16H+ ,
故答案为:5S2O82-+2Mn2++8H2O![]() 10SO42-+2MnO4-+16H+;
10SO42-+2MnO4-+16H+;
(3)反应Hg2+(aq)+HS-(aq)![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038=/span>
HgS(s)+H+(aq)的平衡常数K=1.75×1038=/span>![]() =
=![]() =
=![]() =
=![]() ,解得:Ksp(HgS)= 4.0×10-53,故答案为:4.0×10-53;
,解得:Ksp(HgS)= 4.0×10-53,故答案为:4.0×10-53;
(4)由电化学脱硫法装置示意图可知,该装置为电解池,烟气经催化氧化后,部分二氧化硫被氧化为三氧化硫,所得气体通入该装置,在阴极上,氧气得到电子发生还原反应,电极反应式为:O2+4e-+2SO3=2SO42-;在阳极,SO2失电子被氧化为SO3,电极反应式为:SO2-2e-+SO42-=2SO3,三氧化硫经氮气导出与水反应生成硫酸,这样,不仅可脱除烟气中的SO2还可以制得硫酸,在阴极放电的物质是O2,在阳极生成SO3的电极反应式是SO2-2e-+SO42-=2SO3,
故答案为:O2 ;SO2-2e-+SO42-=2SO3。

【题目】表中是常温下某些一元弱酸的电离常数:
弱酸 | HF | HNO2 | HCN | CH3COOH |
电离常数 | 6.8×10-4 | 6.4×10-6 | 6.2×10-10 | 1.8×10-6 |
则0.1mol/L的下列溶液中,酸性最强的是( )
A.CH3COOHB.HNO2C.HCND.HF

