题目内容
【题目】下表为元素周期表的一部分:
C | N | |||
X | Y | Z | Cl |
回答下列问题:
(1)Y在元素周期表中的位置为__________,X的简单离子结构示意图为_______________。
(2)表中元素中:原子半径最大的是_________(填元素符号),最高价氧化物对应水化物的酸性最强的是______________(填化学式)。
(3)下列事实能说明氯的非金属性比氮强的事实是________(填字母)。
a.Cl2的沸点比N2的高 b.3Cl2+2NH3=6HCl+N2
c.Cl2中原子间为含单键,N2中原子间为三键 d.HCl和NH3受热分解,HCl分解温度高
(4)碳与X可形成化合物M,M的相对分子质量为144。M与盐酸反应的化学方程式为___________。
【答案】 第三周期ⅤA族 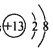 Al HClO4 bd Al4C3 + 12HCl=4AlCl3+3CH4 ↑
Al HClO4 bd Al4C3 + 12HCl=4AlCl3+3CH4 ↑
【解析】表中的各元素为
C | N | |||
X-Al | Y-P | Z-S | Cl |
(1)Y为P,在元素周期表中的位置为第三周期ⅤA族;X的简单离子为Al3+,结构示意图为 ;(2)同一周期:随核电荷数的递增,原子半径逐渐减小(除稀有气体原子外),同一主族:随核电荷数的递增,原子半径逐渐增大,从表中元素中:原子半径最大的是Al;元素周期表中同一周期的主族元素,从左到右原子半径逐渐减小,失电子的能力逐渐减弱,得电子的能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强,最高价氧化物对应水化物的酸性,逐渐增强,最强的是HClO4;(3)a.沸点高低与元素的非金属性没有必然联系,故a错误;b、3Cl2+2NH3=6HCl+N2,非金属性强的单质能把非金属性弱的单质置换出来,故b正确;c.成键数目的多少与元素的非金属性没有必然联系,故C错误;d、元素的非金属性越强,对应氢化物的稳定性越强,HCl和NH3受热分解,HCl分解温度高,可说明氯元素的非金属性比氮元素强,故d正确;故选bd。(4)碳与Al可形成化合物M,M的相对分子质量为144,结合元素的化合价,Al为+3价,C为-4价,得M的化学式为 Al4C3。M与盐酸反应的化学方程式为Al4C3 + 12HCl=4AlCl3+3CH4 ↑。
;(2)同一周期:随核电荷数的递增,原子半径逐渐减小(除稀有气体原子外),同一主族:随核电荷数的递增,原子半径逐渐增大,从表中元素中:原子半径最大的是Al;元素周期表中同一周期的主族元素,从左到右原子半径逐渐减小,失电子的能力逐渐减弱,得电子的能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强,最高价氧化物对应水化物的酸性,逐渐增强,最强的是HClO4;(3)a.沸点高低与元素的非金属性没有必然联系,故a错误;b、3Cl2+2NH3=6HCl+N2,非金属性强的单质能把非金属性弱的单质置换出来,故b正确;c.成键数目的多少与元素的非金属性没有必然联系,故C错误;d、元素的非金属性越强,对应氢化物的稳定性越强,HCl和NH3受热分解,HCl分解温度高,可说明氯元素的非金属性比氮元素强,故d正确;故选bd。(4)碳与Al可形成化合物M,M的相对分子质量为144,结合元素的化合价,Al为+3价,C为-4价,得M的化学式为 Al4C3。M与盐酸反应的化学方程式为Al4C3 + 12HCl=4AlCl3+3CH4 ↑。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 常温下,加水稀释醋酸,![]() 增大
增大
C. 多元弱酸的酸性主要由第一步电离决定
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
