题目内容
15. 实验室常用KMnO4与浓盐酸反应制取氯气:
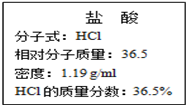
实验室常用KMnO4与浓盐酸反应制取氯气:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O某同学将一定质量的KMnO4溶解在100mL 过量浓盐酸(右图为该浓盐酸试剂瓶标签上的有关数据)中,收集到4.48L 氯气(标准状况).请计算:
(1)此浓盐酸的物质的量浓度是多少?
(2)反应耗用KMnO4的质量是多少?
分析 (1)结合c=$\frac{1000ρw%}{M}$计算;
(2)n(Cl2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,结合反应及m=nM计算.
解答 解:(1)由图中信息可知密度、质量分数及摩尔质量,则c(HCl)=$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L,
答:此浓盐酸的物质的量浓度是11.9mol/L;
(2)n(Cl2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,由2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O可知,消耗n(KMnO4)=0.2mol×$\frac{2}{5}$=0.08mol,则其质量为0.08mol×158g/mol=12.64g,答:反应耗用KMnO4的质量是12.64g.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及物质的量相关计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
3.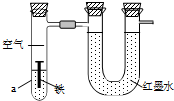 如图用来研究钢铁制品的腐蚀,装置的气密性良好,且开始时U形管两端的红墨水液面相平.一段时间后能观察到铁钉生锈.下列说法不正确的是( )
如图用来研究钢铁制品的腐蚀,装置的气密性良好,且开始时U形管两端的红墨水液面相平.一段时间后能观察到铁钉生锈.下列说法不正确的是( )
 如图用来研究钢铁制品的腐蚀,装置的气密性良好,且开始时U形管两端的红墨水液面相平.一段时间后能观察到铁钉生锈.下列说法不正确的是( )
如图用来研究钢铁制品的腐蚀,装置的气密性良好,且开始时U形管两端的红墨水液面相平.一段时间后能观察到铁钉生锈.下列说法不正确的是( )| A. | 铁钉表面发生的反应为Fe-3e-=Fe3+ | |
| B. | 若液体a为稀盐酸,则U形管液面右高左低 | |
| C. | 若液体a为食盐水,则U形管液面左高右低 | |
| D. | 若液体a为食用油,则铁钉生锈速率较慢 |
10.小明为研究添加食品中的食盐中的碘酸钾的稳定性,查阅文献得到相关信息如下,回答下列问题
(1)相同温度下,pH=0时,碘酸钾最不稳定.
(2)pH=7时,随着温度的升高碘酸钾的稳定性减弱.(填“增强”,“不变”或“减弱”);
(3)小明猜想,碘酸钾因转化为碘单质.请设计一个实验方案证明是否有碘单质生成:取样,加淀粉溶液,如溶液变蓝说明有碘生成,反之,没碘生成.
| 编号 | 碘酸钾浓度/mol/L | pH | 碘酸钾损失率/% | |||
| 30℃ | 50℃ | 80℃ | 100℃ | |||
| 1 | 0.003 | 0 | 21 | 70.3 | 71 | 77.3 |
| 2 | 0.003 | 7 | 0 | 0.3 | 0.67 | 1 |
| 3 | 0.003 | 14 | 1.3 | 2.7 | 1.3 | 1 |
(2)pH=7时,随着温度的升高碘酸钾的稳定性减弱.(填“增强”,“不变”或“减弱”);
(3)小明猜想,碘酸钾因转化为碘单质.请设计一个实验方案证明是否有碘单质生成:取样,加淀粉溶液,如溶液变蓝说明有碘生成,反之,没碘生成.
20.下列制取蒸馏水的实验装置与操作的说法中,不正确的是( )
| A. | 可用过滤的方法制取蒸馏水 | |
| B. | 冷凝器中的水流方向是从下口进入,上口排出 | |
| C. | 实验中需要在蒸馏烧瓶中加入几片碎瓷片或沸石 | |
| D. | 给蒸馏烧瓶加热时要垫上石棉网 |
7.下列实验事实陈述正确并且有因果关系的是( )
| A. | 滴加BaC12溶液生成白色沉淀 原溶液中有SO42- | |
| B. | 用洁净铂丝蘸取溶液进行焰色反应:火焰呈黄色 原溶液中有Na+无K+ | |
| C. | 滴加氯水和CC14,振荡、静置.下层溶液显紫色 原溶液中有I- | |
| D. | 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝 原溶液中无NH4+ |
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液CuSO4;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液CuSO4;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: