题目内容
4.物质的量是一个联系宏观和微观的物理量.填写关于物质的量计算的四个恒等式(NA表示阿伏加德罗常数):n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$=CV.
分析 n与m、N、V成正比,物质的量=溶液体积×溶液物质的量浓度,据此分析解答.
解答 解:n与m、N、V、C的关系知,n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$=CV,
故答案为:$\frac{m}{M}$;$\frac{N}{{N}_{A}}$;$\frac{V}{{V}_{m}}$;CV.
点评 明确各个物理量关系是解本题关键,熟悉物质的量有关公式并灵活运用,题目难度不大,注意气体摩尔体积适用范围及适用条件.

练习册系列答案
相关题目
19.下列各组溶液不加任何试剂就能鉴别的是( )
| A. | 碳酸钠、氢氧化钠、酚酞 | B. | 氢氧化钠、氢氧化钡、硫酸 | ||
| C. | 硫酸、碳酸钠、氢氧化钠 | D. | 硫酸铜、盐酸、硫酸 |
12.用NA表示阿伏加德罗常数,下列有关说法正确的是( )
| A. | 在常温常压下,11.2LO2含有的分子数为0.5NA | |
| B. | 在常温常压下,1mol氦气含有的原子数为2NA | |
| C. | 71gCl2所含原子数为2NA | |
| D. | 标准状况下,1molH2O和1 molH2的体积都约为22.4L |
19.氟氧酸是较新颖的氧化剂,应用性极强,可用被氮气稀释的氟气在细冰上缓慢通过制得:F2+H2O=HOF+HF.该反应中水的作用与下列反应中水的作用相同的是( )
| A. | 钠与水反应制氢气 | B. | 过氧化钠与水反应制氧气 | ||
| C. | 氯气与水反应制次氯酸 | D. | 氟单质与水反应制氧气 |
9.莫尔盐[(NH4)2Fe(SO4)2•6H2O]常作氧化还原滴定的基准物质,在1L 0.1mol/L的该盐溶液中,下列有关比较正确的是( )
| A. | c(NH4+)+c(NH3•H2O)=0.1 mol/L | B. | 2c(Fe2+)+c(NH4+)=2c(SO42-) | ||
| C. | c(NH4+):c(Fe2+):c(SO42-)=2:1:2 | D. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
16.下列有关离子方程式书写正确的是( )
| A. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═AlO${\;}_{2}^{-}$+2H2↑ | |
| B. | 铜片投入少量FCl3溶液中:3Cu+2Fe3+═2Fe+3Cu2+ | |
| C. | .Ca(CHO3)2溶液与足量澄清石灰水混合:Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| D. | 用铁棒作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+ |
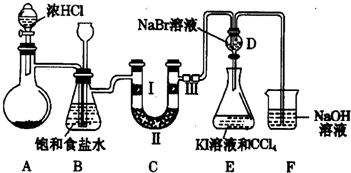
13.用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硫酸 | Na2S | AgNO3与 AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| B | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性:MnO2>Cl2>Br2 | |
| C | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
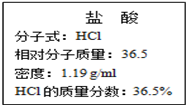 实验室常用KMnO4与浓盐酸反应制取氯气:
实验室常用KMnO4与浓盐酸反应制取氯气: