题目内容
【题目】铈元素(Ce)是镧系金属中自然丰度最高的一种,常见价态有+3、+4,铈的合金耐高温,可以用来制造喷气推进器零件。
(1)雾霾中含有大量的污染物NO,可以被Ce4+溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1),该反应氧化剂与还原剂的物质的量之比为___________。
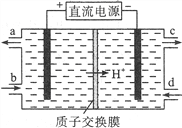
(2)可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如右图所示。
①Ce4+从电解槽的__________(填字母序号)口流出。
②写出阴极的电极反应式____________________________。每消耗1mol NO2-,阴极区H+物质的量减少______mol。
(3)铈元素在自然中主要以氟碳矿形式存在,主要化学成分为CeFCO3,工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下:
①焙烧过程中发生的主要反应方程式为______________________________________。
②酸浸过程中有同学认为用稀硫酸和H2O2替换盐酸更好,他的理由是_________________________。
③Ce(BF4)3、KBF4的Ksp分别为a、b,则Ce(BF4)3(s) + 3KCl(aq)![]() 3KBF4(s) + CeCl3 (aq)平衡常数为______________________。
3KBF4(s) + CeCl3 (aq)平衡常数为______________________。
④加热CeCl3·6H2O和NH4Cl的固体混合物可得到无水CeCl3,其中NH4Cl的作用是______________________。
【答案】2:1a2NO2 - +8H++6e—=N2↑+4H2O14CeFCO3+ O2![]() 3 CeO2+ CeF4+4CO2不释放氯气,减少对环境的污染
3 CeO2+ CeF4+4CO2不释放氯气,减少对环境的污染![]() NH4Cl固体分解出HCl气体,抑制CeCl3水解
NH4Cl固体分解出HCl气体,抑制CeCl3水解
【解析】(1)NO被Ce4+溶液氧化为NO2-、NO3-(二者物质的量之比为1∶1),Ce4+被还原为Ce3+,该反应的离子方程式为4 Ce4++2NO+3H2O==4 Ce3+ +NO2-+NO3-+6H+,Ce4+为氧化剂,NO为还原剂,二者的物质的量之比为2:1。
(2)采用电解法将吸收液中的NO2-转化为无毒物质N2,发生还原反应,电极反应式为2NO2 - +8H++6e—=N2↑+4H2O,Ce3+被氧化为Ce4+,电极反应式为Ce3+-e-=Ce4+。①分析电解装置知左侧电极为电解池的阳极,电极反应式为Ce3+-e-=Ce4+,故Ce4+从电解槽的a口流出。②右侧电极为电解池的阴极,发生还原反应,电极反应式为2NO2 - +8H++6e—=N2↑+4H2O ;根据电极反应式和电荷守恒知每消耗1mol NO2-,阴极区H+物质的量减少1mol。
(3)①焙烧过程中,CeFCO3和 O2反应生成CeO2、 CeF4和CO2,利用化合价升降法配平,反应方程式为4CeFCO3+ O2![]() 3 CeO2+ CeF4+4CO2 。②酸浸过程中,+4价Ce被还原为+3价,HCl被氧化生成有毒气体氯气,污染环境。用稀硫酸和H2O2替换盐酸,H2O2的氧化产物为氧气,不释放氯气,减少对环境的污染 。③反应:Ce(BF4)3(s) + 3K+(aq)
3 CeO2+ CeF4+4CO2 。②酸浸过程中,+4价Ce被还原为+3价,HCl被氧化生成有毒气体氯气,污染环境。用稀硫酸和H2O2替换盐酸,H2O2的氧化产物为氧气,不释放氯气,减少对环境的污染 。③反应:Ce(BF4)3(s) + 3K+(aq)![]() 3KBF4(s) + Ce3+(aq)的平衡常数K=c(Ce3+)/c3(K+),Ce(BF4)3的Ksp= c(Ce3+) c3(BF4-)=a,KBF4的Ksp= c(K+) c(BF4-)=b,则Ce(BF4)3(s) + 3KCl(aq)
3KBF4(s) + Ce3+(aq)的平衡常数K=c(Ce3+)/c3(K+),Ce(BF4)3的Ksp= c(Ce3+) c3(BF4-)=a,KBF4的Ksp= c(K+) c(BF4-)=b,则Ce(BF4)3(s) + 3KCl(aq)![]() 3KBF4(s) + CeCl3 (aq)平衡常数K=Ksp[Ce(BF4)3]/ Ksp3(KBF4)=
3KBF4(s) + CeCl3 (aq)平衡常数K=Ksp[Ce(BF4)3]/ Ksp3(KBF4)=![]() 。④加热CeCl3·6H2O时,Ce3+水解,得不到无水CeCl3。加热CeCl3·6H2O和NH4Cl的固体混合物时,其中NH4Cl固体分解出HCl气体,抑制CeCl3水解。
。④加热CeCl3·6H2O时,Ce3+水解,得不到无水CeCl3。加热CeCl3·6H2O和NH4Cl的固体混合物时,其中NH4Cl固体分解出HCl气体,抑制CeCl3水解。



