题目内容
【题目】FeCO3与砂糖混用可作补血剂。以黄铁矿烧渣(含CuO、Fe2O3、FeO、SiO2、Al2O3等)为主要原料制备FeCO3的流程如下:
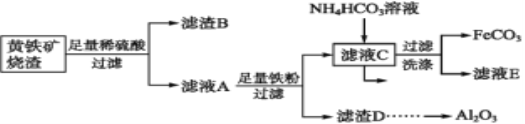
(1)质量分数为30%(密度是1.176 g·cm-3)的稀硫酸的物质的量浓度为________。
(2)检验滤液A中存在Fe2+的试剂是________。
(3)加入足量铁粉的作用除调节pH使Al3+转化为Al(OH)3沉淀外,还有两个作用,分别写出这两个反应的离子方程式:____________ , ________________。
(4)写出滤液C与NH4HCO3溶液反应的离子方程式:_____________________。
(5)FeCO3在空气中灼烧可制得铁系氧化物材料。已知25 ℃,101 kPa时:
4Fe(s)+3O2(g)![]() 2Fe2O3(s)ΔH=-1 648 kJ·mol-1
2Fe2O3(s)ΔH=-1 648 kJ·mol-1
C(s)+O2(g)![]() CO2(g)ΔH=-393 kJ·mol-1
CO2(g)ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g)![]() 2FeCO3(s)ΔH=-1 480 kJ·mol-1
2FeCO3(s)ΔH=-1 480 kJ·mol-1
写出FeCO3在空气中灼烧生成Fe2O3的热化学方程式:________。
(6)某兴趣小组为充分利用副产品,欲利用滤渣D为原料制取Al2O3,请补充完成实验步骤:向滤渣D中加入适量________溶液,_______________________________。
【答案】 3.6 mol·L-1 酸性KMnO4溶液 Fe+2Fe3+![]() 3Fe2+ Fe+Cu2+
3Fe2+ Fe+Cu2+![]() Fe2++Cu Fe2++2HCO3--
Fe2++Cu Fe2++2HCO3--![]() FeCO3↓+CO2↑+H2O 4FeCO3(s)+O2(g)
FeCO3↓+CO2↑+H2O 4FeCO3(s)+O2(g)![]() 2Fe2O3(s)+4CO2(g)ΔH=-260 kJ·mol-1 NaOH 过滤,向滤液中通入足量CO2,过滤并洗涤沉淀,加热所得沉淀至恒重,即可得氧化铝
2Fe2O3(s)+4CO2(g)ΔH=-260 kJ·mol-1 NaOH 过滤,向滤液中通入足量CO2,过滤并洗涤沉淀,加热所得沉淀至恒重,即可得氧化铝
【解析】(1)考查物质的量浓度的计算,c=1000ρw%/M=1000×1.176×30%/98mol·L-1=3.6mol·L-1;(2)本题考查离子的检验,滤液A中含有的离子是H+、Al3+、Fe3+、Fe2+、Cu2+、SO42-,检验Fe2+,可以利用Fe2+的还原性,即加入KMnO4溶液、溴水等,如果溶液颜色褪去,说明溶液中含有Fe2+,也可以用铁氰化钾溶液,出现蓝色沉淀,说明存在Fe2+;(3)考查铁及其化合物的性质,滤液A中含有离子是H+、Al3+、Fe3+、Fe2+、Cu2+、SO42-,加入铁单质,发生的离子方程式为Fe+2Fe3+=3Fe2+、Fe+Cu2+=Cu+Fe2+;(4)根据流程,加入NH4HCO3溶液后,得到FeCO3,离子反应方程式为Fe2++2HCO3-- FeCO3↓+CO2↑+H2O ;(5)考查热化学反应方程式的计算,FeCO3与氧气的反应是4FeCO3+O2=2Fe2O3+4CO2↑,①4Fe(s)+3O2(g) =2Fe2O3(s),②C(s)+O2(g)= CO2(g),③2Fe(s)+2C(s)+3O2(g)=2FeCO3,根据盖斯定律,①+②×4-③×2,得到:△H=(-1648-393×4+1480×2)kJ·mol-1=-260kJ·mol-1,即热化学反应方程式为4FeCO3(s)+O2(g) =2Fe2O3(s)+4CO2(g)ΔH=-260 kJ·mol-1;(6) 考查物质的制备, 根据问题(3),滤渣D含有成分是Fe、Cu、Al(OH)3,利用氢氧化铝的两性,加入适量的NaOH,然后过滤,向滤液中通入足量CO2,过滤并洗涤沉淀,加热所得沉淀至恒重,即可得氧化铝。

【题目】氢气是一种理想的绿色能源。
(1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为______________;
②该反应的热化学方程式为________________________________;
(2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)===MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)===Mg2NiH4(s) ΔH2;
Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1。
则ΔH2=____________kJ·mol-1;
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
(3)倒入NaOH溶液的正确操作是_______________(从下列选出)。
A.沿玻璃棒缓慢倒入 B.一次迅速倒入 C.分三次少量倒入
(4)使硫酸与NaOH溶液混合均匀的正确操作是_________(从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=______________(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是:___________。(任意写出一点)