题目内容
【题目】用电解法可提纯含有某种钾的含氧酸盐杂质(如硫酸钾、碳酸钾等)的粗KOH容液,其工作原理如图所示。
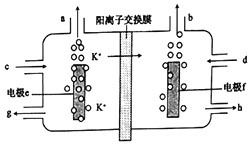
下列说法正确的是( )
A. 电极f为阳极,电极e上H+发生还原反应
B. 电极e的电极反应式为4OH--4e-=2H2O+O2↑
C. d处流进粗KOH溶液,g处流出纯KOH溶液
D. b处每产生11.2L气体,必有1molK+穿过阳离子交换膜
【答案】B
【解析】根据图示,K+移向电极f,所以f是阴极,e是阳极,阳极OH-发生氧化反应生成氧气,故A错误;e是阳极,阳极OH-发生氧化反应生成氧气,电极e的电极反应式为4OH--4e-=2H2O+O2↑,故B正确;c处流进粗KOH溶液,h处流出纯KOH溶液,故C错误;f是阴极,H+发生还原反应生成氢气,非标准状况下11.2L氢气的物质的量不一定是0.5mol,故D错误。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】CrSi、Ge-GaAs、ZnGeAs2、聚吡咯、碳化硅和氧化亚铜都是重要的半导体化合物。回答下列问题:
(1)基态铬原子的核外电子排布式为___________,其中未成对电子数为____________。
(2) Ge-GaAs中元素Ge、Ga、As的第一电离能从大到小的顺序为_______________。ZnGeAs2中Zn、Ge、As的电负性从大到小的顺序为________________。
(3)聚吡咯的单体为吡咯(![]() ),该分子中氮原子的杂化轨道类型为__________;分子中σ键与π键的数目之比为________________。
),该分子中氮原子的杂化轨道类型为__________;分子中σ键与π键的数目之比为________________。
(4)碳化硅、晶体硅及金刚石的熔点如下表:
立方碳化硅 | 晶体硅 | 金刚石 | |
熔点/℃ | 2973 | 1410 | 3550~4000 |
分析熔点变化规律及其差异的原因:__________________________________________________。
(5)氧化亚铜的熔点为1235℃,其固态时的单晶胞如下图所示。
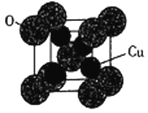
①氧化亚铜属于__________晶体。
②已知Cu2O的晶胞参数a=425.8pm,则其密度为__________ g·cm-3(列出计算式即可)。
【题目】五氯化磷(PCl5)常温下是一种淡黄色固体,在潮湿空气中水解产生两种酸。PCl5在有机合成中被广泛用作氯化剂、催化剂、脱水剂等,高纯度PCl5主要用于医药中间体及锂电池原材料的合成。工业生产PCl5的传统方法是在搅拌式反应釜中注入液体三氯化磷(PCl3),再通入氯气在合适的温度下发生反应:PCl3+Cl2![]() PCl5。某工厂对传统方法进行了改进以生产高纯度PCl5,主要流程如下图所示(循环水的作用是控制温度)。
PCl5。某工厂对传统方法进行了改进以生产高纯度PCl5,主要流程如下图所示(循环水的作用是控制温度)。
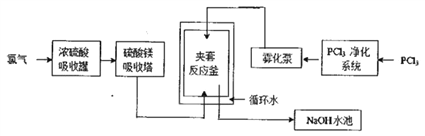
请回答下列相关问题。
(1)工业生产氯气的主要方法的离子方程式是___________,利用该反应所得产品可继续生产_________(任写一种)等化工产品。
(2)浓硫酸吸收罐和硫酸镁吸收塔的作用是______________________,若去掉这两个设备夹套反应釜中发生的主要副反应是______________________________。
(3)夹套反应釜中的原料混合方式与搅拌式反应釜相比主要优点是____________________________。 (4)NaOH水池的作用是_______________________,从降低生产成本的角度考虑NaOH溶液可更换为______。
(5)生产过程中PCl3的加料速率会对生产造成明显的影响,具体情况如下表。根据表中数据判断最佳的加料速率范围是_________________kg·h-1。
PCl3加料速率/kg·h-1 | PCl5状态 | 热交换情况 | 生产500kg产品的周期/h |
40 | 致密、坚硬、造粒困难 | 快、温度可控 | 11.5 |
50 | 致密、坚硬、造粒困难 | 快、温度可控 | 9.2 |
60 | 较松散、造粒容易 | 较快、温度可控 | 7.2 |
70 | 松散、造粒容易 | 较快、温度可控 | 6.5 |
80 | 松散、造粒容易 | 慢、温度升高难以控制 | 5.3 |