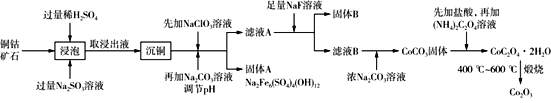
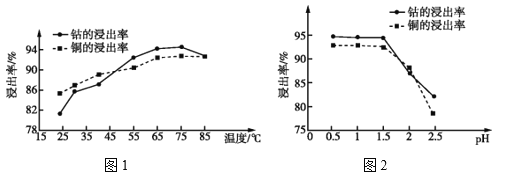
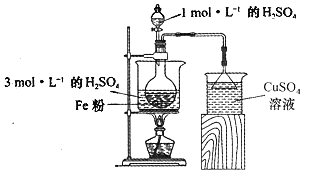
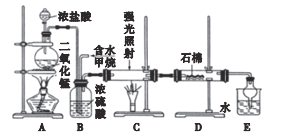
题目内容
【题目】汽车尾气中含有CO、NO、NO2、碳氢化合物等多种污染物。回答下列问题:
(1)汽车燃料中不含氮元素,尾气中所含NO产生的原因是_________________________(用化学方程式表示)。
(2)已知:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(g) △H1=-5316 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746 kJ·mol-1
①若H2O(l)=H2O(g) △H=+44 kJ·mol-1,则表示正丁烷燃烧热的热化学方程式为__________________。
②部分化学键键能数据为:氧分子中氧氧键的键能为494 kJ·mol-1;C=O的键能为799 kJ·mol-1;CO分子中碳氧键的键能为1076 kJ·mol-1;请计算出反应2CO(g)+O2(g)=2CO2(g)的△H=______________kJ·mol-1,由此可以计算△H2=__________kJ·mol-1
(3)1573K时,N2+O2![]() 2NO平衡常数为2.0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0.2mol、0.001mol,则生成NO的物质的量为_____________mol,N2的转化率为____________。
2NO平衡常数为2.0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0.2mol、0.001mol,则生成NO的物质的量为_____________mol,N2的转化率为____________。
(4)T<500K时,反应NO2(g)+CO(g)=NO(g)+CO2(g)分两步进行:
第一步:NO2(g)+NO2(g)=NO3(g)+NO(g) (慢反应)
第二步:NO3(g)+CO(g)=NO(g)+CO2(g) (快反应)
下列表述正确的是__________(填标号)
A.反应速率与NO2浓度有关 B.反应速率与NO浓度有关
C.反应的中间产物只有NO3 D.第一步反应活化能较低
【答案】N2+O2![]() 2NO C4H10(g) +
2NO C4H10(g) +![]() O2 (g) = 4CO2(g) + 5H2O(l) ΔH=-2878 kJ·mol-1 -550 +196 2.0×10-5 0.005% AC
O2 (g) = 4CO2(g) + 5H2O(l) ΔH=-2878 kJ·mol-1 -550 +196 2.0×10-5 0.005% AC
【解析】
(1)进入气缸的气体是空气,含有氮气和氧气在高温下反应;
(2)①根据盖斯定律计算;
②△H=反应物的总键能-生成物的总键能;
(3)利用平衡常数和三段式进行计算;
(4)利用反应原理分析;
(1)进入气缸的气体是空气,含有氮气和氧气在高温下反应生成一氧化氮,污染空气,方程式是N2+O2![]() 2NO ,
2NO ,
故答案是:N2+O2![]() 2NO ;
2NO ;
(2)① ①2C4H10(g)+13O2(g)=8CO2(g)+10H2O(g) △H1=-5316 kJ·mol-1
②H2O(l)=H2O(g) △H=+44 kJ·mol-1,
(①-②×10)÷2得
C4H10(g) +![]() O2 (g) = 4CO2(g) + 5H2O(l) ΔH=-2878 kJ·mol-1
O2 (g) = 4CO2(g) + 5H2O(l) ΔH=-2878 kJ·mol-1
故答案为:C4H10(g) +![]() O2 (g) = 4CO2(g) + 5H2O(l) ΔH=-2878 kJ·mol-1 ;
O2 (g) = 4CO2(g) + 5H2O(l) ΔH=-2878 kJ·mol-1 ;
②△H=反应物的总键能-生成物的总键能=2×1076 kJ·mol-1+494 kJ·mol-1-2×2×799 kJ·mol-1=-550 kJ·mol-1;
①2CO(g)+O2(g)=2CO2(g) △H=-550kJ·mol-1
②2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746 kJ·mol-1
有盖斯定律得:①-②得N2(g)+O2(g)=2NO(g) △H2=196 kJ·mol-1
故答案为:-550;+196;c(NO)2
(3) N2+O2![]() 2NO,K=
2NO,K=![]() =
=![]() =2.0×10-6,解得n(NO)=2.0×10-5,
=2.0×10-6,解得n(NO)=2.0×10-5,
消耗的氮气的物质的量是1.0×10-5,氮气的转化率=![]() ×100%= 0.005%
×100%= 0.005%
故答案为:2.0×10-5 ;0.005%;
(4)A.第一步是慢反应,决定整个反应的速率快慢,所以反应速率与二氧化氮的浓度有关,故A正确;
B.第二步是快反应,不能决定整个反应速率,故反应速率与一氧化氮的浓度无关,故B错误;
C.第一步反应生成的有三氧化氮,三氧化氮又作了第二个反应的反应物,所以是中间产物,故C正确;
D.第一步反应较慢,说明活化能较高,故D错误;
故选:AC。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案