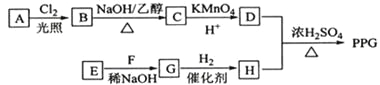
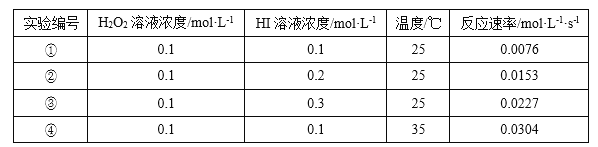
题目内容
【题目】X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的2p电子数是2s电子数的一半,由Y、Z元素组成的某种化合物是一种常用的漂白剂、供氧剂,Z和R位于同周期且R的基态原子中有3个电子能量最高,M2+与过量氨水作用,先得到蓝色沉淀后转化为深蓝色溶液Q。请回答下列问题:
(1)Z、R、M三种元素的第一电离能由大到小的顺序为________(用元素符号表示)。
(2)XCl3、RCl3两种分子中属于非极性分子的是_______ (填化学式)。
(3)已知H2Y2和RH3的相对分子质量相同,H2Y2的熔点为-0.43℃,沸点为158℃,而RH3的熔点为-133℃,沸点为-87.7℃,其主要原因是_________。
(4)X、R元素可形成一种具有立体网状结构的化合物,其晶胞结构如图所示,该化合物的晶体类型是______,化学式为________,X的配位数是________。

【答案】P>Cu>Na BCl3 两种物质均是分子晶体,H2O2分子间存在氢键而PCl3分子间不存在氢键 原子晶体 BP 4
【解析】
X、Y、Z、R、M五种元素的原子序数依次增大,基态X原子的2p电子数是2s电子数的一半,原子核外电子排布为1s22s22p1,则X为B元素;由Y、Z元素组成的一种化合物是一种常用的漂白剂、供氧剂,则Y为O元素、Z为Na;Z和R位于同周期且R的基态原子中有3个电子能量最高,外围电子排布使为3s23p3,故R为P元素;M2+与过量氨水作用先得到蓝色沉淀后转化为深蓝色溶液Q,则M为Cu。
(1)元素的非金属性越强,第一电离能越大,金属性越强,第一电离能越小;
(2)化合物BCl3的B原子孤电子对数为0,杂化轨道数目为3,为平面正三角形,而PCl3中P原子由1对孤对电子,价层电子对数为4,为三角锥形;
(3)H2O2分子之间形成氢键,熔沸点较高;
(4) 具有立体网状结构的化合物的晶体类型为原子晶体;根据均摊法计算晶胞中原子数目,确定化学式;R原子配位数为4,晶体中原子配位数与原子数目呈反比。
根据上述分析可知:X为B元素;Y为O元素、Z为Na元素;R为P元素;M为Cu元素。
(1)Z、R、M三种元素分别是Na、P、Cu,由于元素的非金属性越强,其第一电离能越大,元素的金属性越强,第一电离能越小,所以第一电离能由大到小的顺序为:P>Cu>Na,
(2)化合物BCl3的B原子孤电子对数为0,杂化轨道数目为3,B原子采取sp2杂化,为平面正三角形,分子中正负电荷重心重合,属于非金属性分子;而PCl3中P原子有1对孤对电子,价层电子对数为4,为三角锥形,分子中正负电荷重心不重合,属于极性分子;
(3)H2O2分子之间除存在分子间作用力外,还存在氢键;而PH3分子之间只存在分子间作用力,不能形成氢键,故H2O2熔沸点较高;
(4)X、R元素分别是B、P,二者可形成一种具有立体网状结构的化合物,则该晶体为原子晶体,由其晶胞结构可知,在该晶胞中含有的B原子数为8×![]() =4,晶胞中P原子数目为4,所以该化合物的化学式为BP,R原子配位数为4,晶体中R、X原子数目之比为1:1,故二者配位数相等,则X的配位数是4。
=4,晶胞中P原子数目为4,所以该化合物的化学式为BP,R原子配位数为4,晶体中R、X原子数目之比为1:1,故二者配位数相等,则X的配位数是4。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案