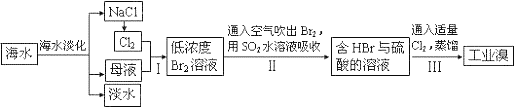
题目内容
【题目】关于右图所示装置(海水为弱碱性)的说法错误的是

A. 若d为石墨,则铁片上的电子反应为:Fe —2e → Fe2+
B. 若d为铜片,则铁片腐蚀加快
C. 若d为锌片,则铁片上的电极反应为:2H+ +2e → H2↑
D. 若d为锌片,则这种保护铁片的方法属于牺牲阳极的阴极保护法
【答案】C
【解析】
A.d为石墨,铁片活泼为负极失电子发生氧化反应,电极反应:Fe-2e-=Fe2+,故A正确;B.d为铜片,活泼金属铁片作负极,发生电化学腐蚀,所以铁片腐蚀加快,故B正确;C.锌比铁片活泼,所以腐蚀锌,铁片不易被腐蚀,因海水为弱碱性,则Fe片发生的电极反应为O2+2H2O+4e-=4OH-,故C错误;D.d为锌块,作为负极,Fe为正极,Fe不易被腐蚀,属于牺牲阳极的阴极保护法,故D正确;故答案为C。

练习册系列答案
相关题目