题目内容
【题目】开发新能源是解决环境污染的重要举措,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。
(1)已知:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)
ΔH1=-1 274.0 kJ/mol
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ/mol
③H2O(g)===H2O(l) ΔH3=-44 kJ/mol
甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为___________________________。
(2)生产甲醇的原料CO和H2可由反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH>0得到。
CO(g)+3H2(g) ΔH>0得到。
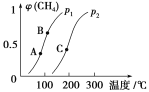
①一定条件下CH4的平衡转化率与温度、压强的关系如图。则p1________p2(填“<”、“>”或“=”)。A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为________________。
②100 ℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是________(填序号)。
a.容器的压强恒定
b.容器内气体密度恒定
c.3v正(CH4)=v逆(H2)
d.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
(3)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示,通入a气体的电极是原电池的________极(填“正”或“负”),其电极反应式为______________________________。

【答案】(1)CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=-442 kJ/mol
(2)①< KA<KB<KC ②ac (3)负 CH3OH-6e-+H2O===CO2↑+6H+
【解析】(1)依据盖斯定律,由(①-②+4×③)÷2得:CH3OH(l) +O2(g)===CO(g)+2H2O(l) ΔH=-442 kJ/mol。(2)①由图可知温度相同,压强为p1时CH4的转化率高于压强为p2时CH4的转化率,该反应为气体分子数增大的反应,减小压强平衡正向移动,则p1<p2。该反应为吸热反应,升高温度平衡右移,平衡常数增大,故KA<KB<KC。②a项,该反应为反应前后气体分子数不相等的反应,容器的压强恒定说明反应达到平衡状态;b项,由于容器体积不变且反应前后气体总质量不变,故容器内气体密度为一定值,b项不能说明反应达到平衡状态;c项说明正逆反应速率相等,反应达到平衡状态;d项描述的是同一反应方向上CH4和H2的物质的量的变化情况,任意时刻均成立,不能说明反应达到平衡状态。(3)根据H+和电子的移动方向知,通入a气体的电极为负极、通入b的电极为正极,图中交换膜是质子交换膜,则电解质溶液呈酸性,负极发生氧化反应,其电极反应式为CH3OH-6e-+H2O===CO2↑+6H+。