题目内容
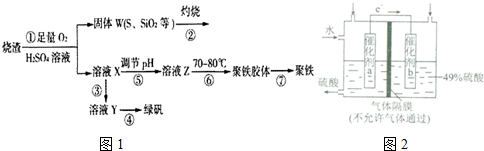
16.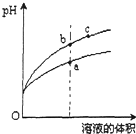 某温度下,相同pH的盐酸和醋酸分别加水稀释,pH随溶液体积变化的曲线如图所示,据图判断下列说法正确的是( )
某温度下,相同pH的盐酸和醋酸分别加水稀释,pH随溶液体积变化的曲线如图所示,据图判断下列说法正确的是( )| A. | b点酸的总浓度大于a点酸的总浓度 | |
| B. | c点溶液的导电性比b点强 | |
| C. | a点Kw的数值比c点溶液的Kw的数值大 | |
| D. | b点水电离产生的c(H+)比a点大 |
分析 根据盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,溶液稀释时,醋酸进一步电离,其溶液中离子浓度大于盐酸的离子浓度,故II应为醋酸稀释时的pH值变化曲线,利用c点、b点溶液中的离子浓度来分析导电性;Kw只与温度有关,与溶液的种类以及浓度大小没有关系;相同pH值的盐酸和醋酸,稀释到相同体积时,醋酸(II)浓度大于盐酸(I)浓度.
解答 解:A、醋酸是弱电解质,氯化氢是强电解质,pH相等的醋酸和盐酸,醋酸浓度大于盐酸,稀释相同的倍数时醋酸浓度仍然大于盐酸浓度,故A错误;
B、溶液导电性取决于离子浓度,b点的H+浓度大,导电性比c点强,故B错误;
C、Kw的大小只取决于温度,故C错误;
D、b点氢离子浓度比a点小,对水的电离抑制作用小,所以b点水电离产生的c(H+)比a点大,故D正确;
故选D.
点评 本题考查强弱电解质溶液稀释时的浓度变化,注意加水促进弱电解质电离的特点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.如图表示298K时N2与H2反应过程中的能量变化.根据如图叙述正确的是( )
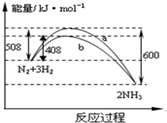

| A. | 该反应的热化学方程式为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g)△H=-92kJ•mol-1 | |
| B. | 不用催化剂,生成1molNH3放出的热量为46kJ,加入催化剂,生成1molNH3放出的热量为小于46kJ | |
| C. | 加入催化剂,降低了正反应的活化能,升高了逆反应的活化能 | |
| D. | 在温度、体积一定的条件下,通入1molN2和3molH2,反应后放出的热量为Q1,若通入2molN2和6molH2,反应后放出的热量为Q2,则Q1<0.5Q2<92KJ |
4.分类是化学学习与研究的常用方法,下列分类正确的是( )
| A. | 碱性氧化物均属于金属氧化物 | |
| B. | 根据电解质在水溶液中的导电性强弱,将电解质分为强电解质和弱电解质 | |
| C. | 根据是否具有丁达尔效应,将分散系分为溶液、胶体和浊液 | |
| D. | 稀豆浆、雾、FeCl3溶液均为胶体 |
11.已知10HNO3(稀)+4Zn=4Zn(NO3)2+a+5H2O,若a为氮的氧化物,则a为( )
| A. | NO | B. | NO2 | C. | N2O | D. | N2O3 |
9.下列离子方程式书写正确的是( )
| A. | 高温下铁与水蒸气反应生成保护膜:2Fe+6H2O(g)═2Fe(OH)3+3H2 | |
| B. | 向新制的氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | 盛放氢氧化钠溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| D. | 向氯化铝溶液中加入过量的氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ |
6.NA表示阿伏加德罗常数的值,下列叙述不正确的是( )


| A. | CO和N2为等电子体,22.4 L的CO气体与l mol N2所含的电子数相等 | |
| B. | 在2.4 g石墨中,含C-C共价键数目为0.3NA | |
| C. | 720 g C60晶体含有0.25NA个晶胞(晶胞如图) | |
| D. | 1mol[Cu(NH3)4]2+中含配位键4 NA |
7.下列各组微粒在指定溶液中一定能大量共存的是( )
| A. | 使酚酞变红的溶液K+、H+、SO42-、2- | B. | 纯碱溶液K+、SO42-、OH-、NO3- | ||
| C. | 澄清石灰水Na+、Fe3+、CO2、Cl- | D. | 稀硫酸溶液Ba2+、Na+、HCO3-、NO3- |