题目内容
科学家预测,氨有望取代氢能,成为重要的新一代绿色能源。下列有关说法不正确的是
A.液氨作为清洁能源的反应原理是4NH3+5O2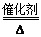 4NO+6H2O 4NO+6H2O |
| B.液氨具有腐蚀性和毒性,在使用过程中要防止液氨泄漏 |
| C.氨气比空气轻,标准状况下密度约为0.76 g·L-1 |
| D.氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全 |
A
解析试题分析:A、液氨作为清洁能源的反应原理是液氨在纯氧中完全燃烧生成水和氮气,所以的化学方程式为4NH3+3O2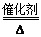 2N2+6H2O,A不正确;B、液氨具有腐蚀性和毒性,在使用过程中要防止液氨泄漏,B正确;C、氨气的相对分子质量小于空气的,因此氨气比空气轻,标准状况下密度约为17g/mol÷22.4L/mol=0.76 g·L-1,C正确;D、氢气是可燃性气体,燃烧易发生爆炸,因此氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全,D正确,答案选A。
2N2+6H2O,A不正确;B、液氨具有腐蚀性和毒性,在使用过程中要防止液氨泄漏,B正确;C、氨气的相对分子质量小于空气的,因此氨气比空气轻,标准状况下密度约为17g/mol÷22.4L/mol=0.76 g·L-1,C正确;D、氢气是可燃性气体,燃烧易发生爆炸,因此氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全,D正确,答案选A。
考点:考查氨气作为新能源的有关判断

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是(注意:HCl与NH3极易反应而生成白烟) ( )
| A.若管道漏气遇氨就会产生白烟 | B.该反应利用了Cl2的强氧化性 |
| C.该反应属于复分解反应 | D.生成1 mol N2有6 mol电子转移 |
NH3是重要的化工原料,可以制备一系列物质(如图所示)。下列说法正确的是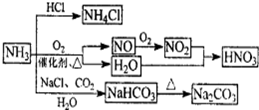
| A.NH4Cl和NaHCO3都是常用的化肥 |
| B.NH4Cl、HNO3和Na2CO3受热时都易分解 |
| C.NH3和NO2在一定条件下可发生氧化还原反应 |
| D.图中所涉及的盐类物质均可以发生水解反应 |
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
| A.洗气瓶中产生的沉淀是碳酸钡 |
| B.在Z导管出来的气体中无二氧化碳 |
| C.洗气瓶中产生的沉淀是亚硫酸钡 |
| D.在Z导管口有红棕色气体出现 |
已知某物质X能发生如下转化: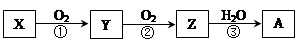
下列有关上述转化关系中物质及其反应的叙述错误的是
| A.若X为N2或NH3,则A为硝酸 |
| B.若X为S或H2S,则A为硫酸 |
| C.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y |
| D.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应 |
不能鉴别二氧化碳与二氧化硫的试剂是
| A.品红溶液 | B.澄清的石灰水 | C.溴水 | D.酸性高锰酸钾溶液 |
某固体粉末中可能含有KNO3、Cu(NO3)2、AgNO3三种物质中的一种或多种,取一定量该固体粉末,加热后得到A气体a L,将气体用足量水吸收,剩余气体B的体积为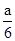 L。下列相关推测错误的是
L。下列相关推测错误的是
| A.气体B可能是O2,也可能是NO |
| B.固体粉末的组成为n(KNO3):n(Cu(NO3)2):n(AgNO3)=1:1:3 |
| C.固体粉末的组成为n(KNO3):n(Cu(NO3)2):n(AgNO3)=1:1:1 |
| D.气体A 中NO2与O2的体积比为9:1 |
将导出H2S气体的导管点燃后伸入盛有一定量O2的集气瓶内,下列3个反应发生的先后顺序是
① 2H2S + O2 → 2S + 2H2O ② 2H2S + SO2 → 3S + 2H2O ③ 2H2S + 3O2 → 2SO2 + 2H2O
| A.①②③ | B.③①② | C.①③② | D.③②① |
近年来,酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)火力发电厂为除去有害气体SO2,并变废为宝,常采用尾气脱硫工艺,如图所示。写出尾气脱硫工艺中反应的化学方程式: 。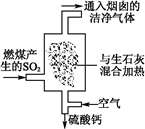
(2)宁波的火力发电厂通常建在海边,一般海水呈弱碱性,主要含有Na+、Mg2+、K+、Ca2+、Cl-、Br-、SO42-、HCO3-等离子。含有SO2的烟气也可以利用海水脱硫,其工艺流程如下图所示: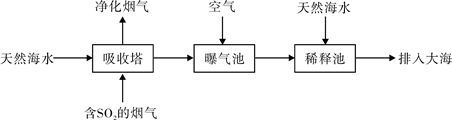
①向曝气池通入空气的目的是 。
②通入空气后的曝气池中的海水与天然海水相比,浓度有明显不同的离子是 。
| A.Cl- | B.Na+ | C.Mg2+ | D.HCO3- |