题目内容
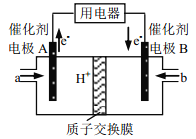
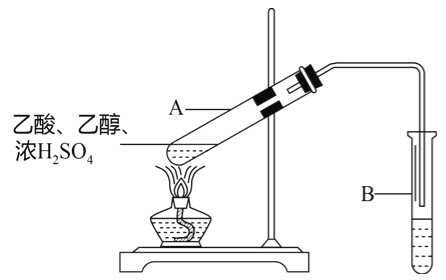
【题目】某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
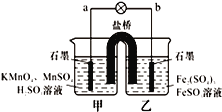
A. 外电路的电流方向是从a到b
B. 甲烧杯中溶液的pH逐渐减小
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. 乙烧杯中发生还原反应
【答案】A
【解析】
A.由上述分析可知,a为正极,b为负极,则电流从a到b,故A正确;B.甲烧杯中发生反应为:MnO4-+8H++5e-═Mn2++4H2O,氢离子浓度减小,导致溶液的pH增大,故B错误;C.阴离子向负极移动,则盐桥中的SO42-移向乙烧杯中,故C错误;D.甲烧杯中(a电极)发生还原反应,Mn元素的化合价降低,电极反应为MnO4-+8H++5e-═Mn2++4H2O,b电极亚铁离子失去电子发生氧化反应,故D错误;故答案为A。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】中科院官微曾给出灰霾中细颗粒物的成因,部分分析如下图所示。


(1)根据如图信息可以看出,所列的气体污染物并非由机动车行驶造成的是______。汽车发动机废气稀燃控制系统主要工作原理如上右图所示;写出稀燃过程中NO发生的主要反应的方程式_____________________________________。
(2)农业活动排出的氨可能是施用的化肥分解,也可能是施用不当导致的。比如某些氮肥与碱性肥料混合施用会释出氨,用离子方程式解释________________________。
(3)经过研究发现我国的霾呈中性,其主要原因如下图所示,A的化学式是________。
2NH3(气)+SO2(气)+2NO2(气)![]() 2NH4+(溶液)+A(溶液)+2HONO(气)
2NH4+(溶液)+A(溶液)+2HONO(气)
(4)煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下(其他极微量离子忽略不计):
离子 | Na+ | SO42- | NO3- | H+ | Cl |
浓度/(mol·L1) | 5.5×103 | 8.5×104 | y | 2.8×104 | 3.5×103 |
①NO和NaClO2溶液反应的离子方程式是___________________。
②表中y=_______。
(5)工业生产硝酸也有可能产生NOx污染。请写出硝酸生产中的第一步:氨的催化氧化的化学方程式___________________________________。若用氮气制氨的产率为90%,用氨生产硝酸时氨的催化氧化和氮氧化物转化为硝酸的损耗依次为5%、3%,1000 mol氮气可制___________mol硝酸。