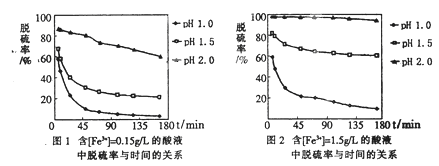
题目内容
K3[Fe(C2O4)3]·3H2O [三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应过程如下,请回下列问题: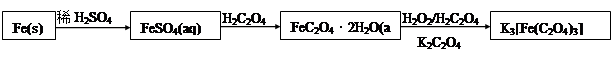
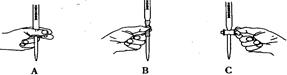
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是 。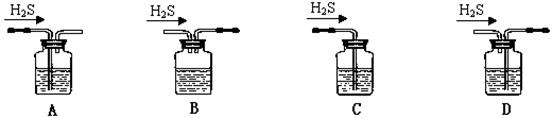
(2)在得到的FeSO4溶液中需加入少量的H2SO4酸化,目的是 ,得到K3[Fe(C2O4)3]溶液后,加入乙醇的目的是 。
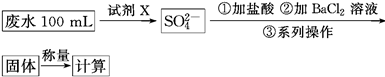
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算。
步骤③需要在干燥器中进行的原因是 ;
步骤⑤的目的是 。
(4)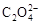 可被酸性KMnO4溶液氧化放出CO2气体,所以实验产物中K3[Fe(C2O4)3]·3H2O含量测定可用KMnO4标准溶液滴定。
可被酸性KMnO4溶液氧化放出CO2气体,所以实验产物中K3[Fe(C2O4)3]·3H2O含量测定可用KMnO4标准溶液滴定。
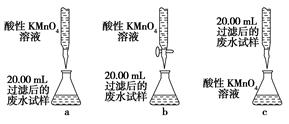
①写出滴定过程中发生反应的离子方程式 ;
②下列滴定操作中使滴定结果偏高的是 ;
| A.滴定管用蒸馏水洗涤后,立即装入标准液 |
| B.锥形瓶在装待测液前未用待测液润洗 |
| C.滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
| D.读取标准液体积时,滴定前仰视读数,滴定后俯视读数 |
(1)A(2)防止Fe2+的水解,三草酸合铁酸钾难溶于乙醇,便于析出(3)防止吸水;确保结晶水全部失去(4)① 2MnO4-+C2O42-+16H+=2Mn2++10CO2↑+8H2O或2 MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)②AC ③49.1%
解析试题解析:(1)A、H2S气体在装置A中可与氢氧化钠溶液充分反后被吸收并使试验气体正常排出,故A正常B、H2S气体在装置B中不能与氢氧化钠溶液充分反应就直接排出,故B错误;C、H2S气体在装置C中能与氢氧化钠溶液充分反应但无法排出,故C错误;D、H2S气体在装置B中不能与氢氧化钠溶液充分反应且通气后瓶内气压增大会将溶液排出,故D错误;(2)由于亚铁离子能够在溶液中发生水解反应,所以加入硫酸抑制了亚铁离子的水解,亚铁离子容易被双氧水氧化成铁离子,故答案为:防止Fe2+水解;使Fe2+氧化为Fe3+;(3)步骤③需要在干燥器中进行,防止晶体吸收空气中的水分;重复步骤②~④至恒重,保证结晶水完全失去,故答案为:防止吸收空气中的水;检验晶体中的结晶水是否已全部失去;(4)①由题意可知 2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O或2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O);②A、管壁有残留的蒸馏水稀释标准溶液,使滴定结果偏高,故A正确;B、在实验操作中锥形瓶使用前不能用待测液润洗,若使用待测液润洗会导致滴定结果偏高,故B不会导致结果偏高;C、滴定后气泡消失会增大待测液的计算体积,使滴定结果偏高,故C正确;D、读取标准溶液时,滴定前仰视读数,滴定后俯视读数,会使读取的标准溶液体积减少,使滴定结果偏小,故D错误。③
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
0.1×0.024 m
2×158 5×88
求出发生反应的C2O42-质量,再根据反应中使用C2O42-的质量求出K3[Fe(C2O4)3]·3H2O的质量分数为49.1%。
考点:实验方案的设计;氧化还原反应;

 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案Ⅰ.下列实验操作中正确的是
| A.分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.蒸发结晶时应将溶液直接蒸干 |
| D.称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上 |
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ② | Mg产生气泡速率快于Fe,Cu无明显变化 | 金属性质越活泼,反应速率越快 |
(2)甲同学的实验目的是探究 。
乙同学为了更精确地研究浓度对反应速率的影响,利用下图所示装置进行定量实验。

(3)乙同学在实验中应该测定的数据是 。
(4)乙同学完成实验应选用的实验药品是 。