题目内容
6.完全中和10.2g二元酸H2A生成正盐,用去24g NaOH,则有关此二元酸的下列说法正确是( )| A. | 该酸的摩尔质量为34 | B. | 该酸的分子量为17 | ||
| C. | 10.2g该酸的物质的量是0.3mol | D. | 该酸一定是强酸 |
分析 发生反应2NaOH+H2A=Na2A+2H2O,根据n=$\frac{m}{M}$计算24gNaOH的物质的量,根据方程式计算H2A的物质的量,再根据M=$\frac{m}{n}$计算H2A的摩尔质量,据此确定H2A的相对分子质量.
解答 解:24gNaOH的物质的量为$\frac{24g}{40g/mol}$=0.6mol,则:
2NaOH+H2A=Na2A+2H2O
0.6mol 0.3mol
故H2A的摩尔质量=$\frac{10.2g}{0.3mol}$=34g/mol,
A.该酸的摩尔质量为34g/mol,故A错误;
B.H2A的相对分子质量为34,故B错误;
C.由上述分析可知,酸的物质的量为碱物质的量的$\frac{1}{2}$,即为0.3mol,故C正确;
D.酸碱中和反应,可知酸的通性,不能确定为强酸,故D错误;
故选C.
点评 本题考查化学反应方程式的计算,为高频考点,把握中和反应及物质的量计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
16.下列反应中均可在溶液中进行,能用同一离子方程式表示的是( )
| A. | NaHCO3、Na2CO3分别与盐酸反应 | B. | NaOH、Cu(OH)2分别与硫酸反应 | ||
| C. | Ca(OH)2、CaCl2分别与Na2CO3反应 | D. | Ba(NO3)2、Ba(OH)2分别与稀硫酸反应 |
17.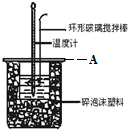 分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O (l)△H=-57.3 kJ/mol;
(2)A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃棒,两个小孔不能开得过大,其原因是减少热量散失;反应需要测量温度,每次测量温度后都必须用水将温度计上的液体冲掉,并擦干温度计;
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).实验时,还需测量的数据有ACE;
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热为△H=-51.8kJ/mol;
(5)假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
 分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O (l)△H=-57.3 kJ/mol;
(2)A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃棒,两个小孔不能开得过大,其原因是减少热量散失;反应需要测量温度,每次测量温度后都必须用水将温度计上的液体冲掉,并擦干温度计;
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).实验时,还需测量的数据有ACE;
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(5)假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
14.下列图示实验操作中,正确的是( )
| A. |  | B. |  | C. |  | D. |  |
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 mol 苯乙烯中含有的碳碳双键数为4NA | |
| B. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1NA | |
| C. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| D. | 足量的Fe和1mol Cl2完全反应,转移的电子数为3NA |
17.人体血红蛋白中不可缺少的是( )
| A. | 单质的铁或铝 | B. | 铁离子的化合物 | C. | 铁元素 | D. | 铝元素 |
14.25℃时,弱酸的电离平衡常数如下表:
下列有关说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1:4.3×10-7 K2:5.6×10-11 |
| A. | 等物质的量浓度的各溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol/L HCN与a mol/L NaOH溶液等体积混合后所得溶液呈中性 | |
| C. | 往冰醋酸中逐滴加水稀释,溶液导电能力始终保持减小 | |
| D. | 等浓度Na2CO3溶液的碱性比NaHCO3溶液的碱性强 |