题目内容
12.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 0.1 mol羟基(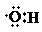 )中含有的电子数为0.7 NA )中含有的电子数为0.7 NA | |
| B. | 1 L 0.1 mol•L-1的AlCl3 溶液中含有Al3+的数目为0.1 NA | |
| C. | 0.1 mol N2与足量H2反应,转移的电子数为0.6 NA | |
| D. | 标准状况下,1.12 L HCHO中C原子的数目为0.05 NA |
分析 A、羟基中含9个电子;
B、铝离子为弱碱阳离子,在溶液中水解;
C、氮气和氢气的反应为可逆反应;
D、求出甲醛的物质的量,然后根据甲醛中含1个碳原子来分析.
解答 解:A、羟基中含9个电子,故0.1mol羟基中含0.9NA个电子,故A错误;
B、铝离子为弱碱阳离子,在溶液中水解,故溶液中的铝离子的个数小于0.1NA个,故B错误;
C、氮气和氢气的反应为可逆反应,不能进行彻底,故转移的电子数小于0.6NA个,故C错误;
D、标况下1.12L甲醛的物质的量为0.05mol,而甲醛中含1个碳原子,故0.05mol甲醛中含0.05NA个碳原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
2.明代宋应星著的《天工开物》中有关于“火法”冶炼锌的工艺记载:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…,冷淀,毁罐取出,…,即倭铅也.”下列说法不正确的是(注:炉甘石的主要成分为碳酸锌)( )
| A. | 该冶炼锌的反应属于置换反应 | |
| B. | 煤炭中起作用的主要成分是C(碳) | |
| C. | 冶炼Zn的反应方程式为:ZnCO3+2C $\frac{\underline{\;高温\;}}{\;}$ Zn+3CO↑ | |
| D. | 倭铅是指金属锌和铅的混合物 |
20.已知草酸为二元中强酸,具有较强还原性,草酸氢钠(NaHC2O4)水溶液呈酸性,下列说法正确的是( )
| A. | 草酸与氢氧化钠溶液混合呈中性时,溶液中存在:c(Na+)=c(HC2O4-)+c(C2O42-) | |
| B. | NaHC2O4与NaClO溶液混合,反应的离子方程式为:HC2O4-+ClO-=HClO+C2O42- | |
| C. | 草酸铵溶液中:c(NH4+)=2 c(H2C2O4)+2 c(HC2O4-)+2 c(C2O42-) | |
| D. | 草酸使酸性KMnO4溶液褪色,其离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O |
17.下列表示对应化学反应的离子方程式正确的是( )
| A. | 金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | Cu与浓硝酸反应制NO2:Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O | |
| C. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 将NaHSO4与Ba(OH)2溶液混合至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
4.下列说法中不正确的是( )
| A. | O2与O3互为同素异形体 | B. | 16O与18O核外电子排布不同 | ||
| C. | 麦芽糖与蔗糖互为同分异构体 | D. | CH3CH3与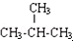 互为同系物 互为同系物 |
1.在下述条件下,一定能大量共存的离子组是( )
| A. | 无色透明的水溶液中:K+、Ba2+、Cu2+、I- | |
| B. | 含有大量H+的水溶液中:NH4+、Fe2+、SO42-、MnO4- | |
| C. | c(HCO3-)=0.1mol/L的溶液中:Na+、K+、CO32-、Br- | |
| D. | 强碱性溶液中:Cl-、SO32-、HSO3-、Na+ |
2.下列离子方式正确的是( )
| A. | 向100mL 0.1mol/L的FeSO4溶液中,加入0.01mol Na2O2固体2Fe2++2Na2O2+2H2O═4Na++2Fe(OH)2+O2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全2Al3++3 SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-?2C6H5OH+CO32- | |
| D. | 向20mL0.5mol/LFeBr2溶液中通入448mLCl2(标准状况):2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |

