题目内容
1.在下述条件下,一定能大量共存的离子组是( )| A. | 无色透明的水溶液中:K+、Ba2+、Cu2+、I- | |
| B. | 含有大量H+的水溶液中:NH4+、Fe2+、SO42-、MnO4- | |
| C. | c(HCO3-)=0.1mol/L的溶液中:Na+、K+、CO32-、Br- | |
| D. | 强碱性溶液中:Cl-、SO32-、HSO3-、Na+ |
分析 A.Cu2+为蓝色;
B.离子之间发生氧化还原反应;
C.该组离子之间不反应;
D.强碱溶液中不能存在酸式酸根离子.
解答 解:A.Cu2+为蓝色,与无色不符,故A不选;
B.Fe2+、H+、MnO4-发生氧化还原反应,不能共存,故B不选;
C.该组离子之间不反应,可大量共存,故C选;
D.强碱溶液中不能存在HSO3-,故D不选;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol羟基(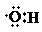 )中含有的电子数为0.7 NA )中含有的电子数为0.7 NA | |
| B. | 1 L 0.1 mol•L-1的AlCl3 溶液中含有Al3+的数目为0.1 NA | |
| C. | 0.1 mol N2与足量H2反应,转移的电子数为0.6 NA | |
| D. | 标准状况下,1.12 L HCHO中C原子的数目为0.05 NA |
9.下列离子方程式不正确的是( )
| A. | 用Cu作阳极电解饱和食盐水:Cu+2H+$\frac{\underline{\;电解\;}}{\;}$Cu2++H2↑ | |
| B. | Fe3O4溶于氢碘酸溶液中:Fe3O4+8H++2I-=3Fe2++I2+4H2O | |
| C. | NH4Al(SO4)2溶于过量的浓Ba(OH)2溶液中:NH4++A13++2SO42-+2Ba2++5OH-=2BaSO4↓+AlO2-+NH3↑+H2O | |
| D. | 澄清石灰水中充入过量的SO2:SO2+OH-=HSO3- |
16.下列离子方程式正确的是( )
| A. | 少量金属钠投入水中:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 60 mL 1 mol/L纯碱溶液与20 mL 2 mol/L胆矾溶液混合(无气体放出):3CO32-+2Cu2++2H2O=2HCO3-+Cu2(OH)2CO3↓ | |
| C. | 向H2O中投入少量Na218O2固体:2H2O+2Na218O2=4Na++418OH-+O2↑ | |
| D. | 向碳酸氢钙溶液中加入少量KOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
6.四种短周期元素W、X、Y、Z,其原子的最外层电子数之和为19,W和X元素原子核的质子数之比为1:2,Y的核外电子数比X多4,Z的核电荷数大于X.下列说法正确的是( )
| A. | 原子半径大小:Z>Y>X>W | |
| B. | 由W元素形成的单质一定是原子晶体,其熔沸点很高 | |
| C. | W、Y、Z三种元素形成的气态氢化物中最稳定的是Z的气态氢化物 | |
| D. | Y、Z所形成的氧化物的水化物的酸性为:Y<Z |
13.仪器名称为“蒸馏烧瓶”的是( )
| A. | 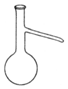 | B. |  | C. |  | D. |  |
10.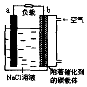 如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )
如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )
 如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )
如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )| A. | a极为负极,发生还原反应 | |
| B. | b电极上电极反应:O2+2H2O+4e-=4OH- | |
| C. | 工作时电子由b极经外电路流向a极 | |
| D. | 该装置实现了电能转化成化学能 |
20.下列溶液暴露于空气中,开始一段时间其pH变小的是(不考虑溶质挥发)( )
①H2S ②H2SO3③Na2S ④Ca(OH)2 ⑤氯水 ⑥Na2SO3.
①H2S ②H2SO3③Na2S ④Ca(OH)2 ⑤氯水 ⑥Na2SO3.
| A. | ①③④ | B. | ②⑤⑥ | C. | ①②④⑤ | D. | ②④⑤⑥ |
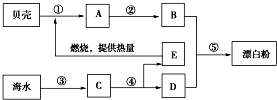 如图的框图是利用海水和海边贝壳为原料设计的制备漂白粉的工艺流程.分析图示各物质的关系,然后回答问题.
如图的框图是利用海水和海边贝壳为原料设计的制备漂白粉的工艺流程.分析图示各物质的关系,然后回答问题.