题目内容
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等.某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质.请填写下列空白:
Ⅰ.测定过氧化氢的含量
(1)移取10.00mL密度为ρ g/mL的过氧化氢溶液至250mL______(填仪器名称)中,加水稀释至刻度,摇匀.移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.
(2)用高锰酸钾标准溶液滴定被测试样,其反应的化学方程式如下:5H2O2+2KMnO4+6HCl=2MnCl2+2KCl+5O2↑+8H2O
(3)滴定时,将高锰酸钾标准溶液注入______(填“酸式”或“碱式”)滴定管中.滴定到达终点的现象是______.
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为______.
Ⅱ.探究过氧化氢的性质
该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性.(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液,实验仪器及用品可自选.)
请将他们的实验方法和实验现象填入下表:
| 实 验 内 容 | 实 验 方 法 | 实 验 现 象 |
| 验证氧化性 | 取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液 | ______ |
| 验证不稳定性 | ______ | 产生气泡,木条复燃. |
解:(1)配制一定物质的量浓度的溶液需要容量瓶,故答案为:容量瓶;
(3)酸性高锰酸钾溶液呈酸性,所以要用酸式滴定管盛放,滴定终点的现象是:滴入一滴高锰酸钾溶液,溶液呈红色,且半分钟内不褪色,
故答案为:酸式,滴入一滴高锰酸钾溶液,溶液呈红色,且半分钟内不褪色;
(4)设25mL双氧水溶液中含有双氧水的质量是x,
5H2O2+6HCl+2KMnO4=2MnCl2+2KCl+5O2↑+8H2O
170g 2mol
x 10-3cVmol
x=0.085 cVg
则250mL双氧水溶液中双氧水的质量是0.85 cVg,双氧水溶液的质量为10ρ g,所以其质量分数= =
=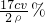 ,故答案为:
,故答案为: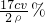 ;
;
II.如果双氧水能使淀粉碘化钾溶液变蓝色,则说明双氧水氧化碘离子生成碘单质,碘遇淀粉变蓝色,所以能证明双氧水有氧化性;
如果将双氧水加热产生能使带火星的木条复燃的物质,则说明双氧水分解生成氧气,所以能证明双氧水不稳定,
故答案为:
| 实验内容 | 实验方法 | 实验现象 |
| 验证氧化性 | 溶液变蓝色 | |
| 验证不稳定性 | 取适量过氧化氢溶液于试管中,加热,用带火星的木条检验. |
分析:(1)配制一定物质的量浓度的溶液需要容量瓶;
(3)酸性溶液要用酸式滴定管量取,滴定终点的现象是:滴入一滴高锰酸钾溶液,溶液呈红色,且半分钟内不褪色;
(4)根据方程式中,高锰酸钾和双氧水之间的关系式计算25mL双氧水中双氧水的质量,从而得出250mL双氧水溶液中双氧水的质量,根据质量分数公式计算即可;
II.如果双氧水能使淀粉碘化钾溶液变蓝色,则证明双氧水有氧化性;
如果将双氧水加热产生能使带火星的木条复燃的物质,则证明双氧水不稳定.
点评:本题考查了实验设计,明确物质的性质是解本题的关键,知道碘遇淀粉变蓝色、氧气能使带火星的木条复燃分别是碘和氧气的特征现象.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案