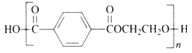
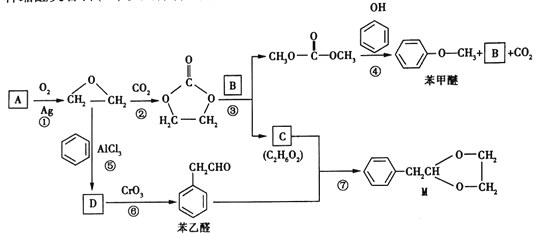
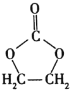
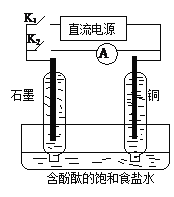
题目内容
【题目】C60 晶体的晶胞结构如图所示,下列说法正确的是( )
A.该晶体熔化时需克服共价键
B.1个晶胞中含有 8 个 C60 分子
C.晶体中 1 个 C60 分子有 12 个紧邻的C60 分子,属于分子密堆积类型
D.晶体中 C60 分子间以范德华力结合,故 C60 分子的热稳定性较差
【答案】C
【解析】
A. 该晶体是分子晶体,熔化时需克服范德华力,故A错误;
B. C60 晶体为面心立方排布,因此1个晶胞中含有4个C60分子,故B错误;
C. C60 晶体为面心立方排布,因此晶体中1个C60分子有12 个紧邻的C60 分子,属于分子密堆积类型,故C正确;
D. 范德华力与分子的热稳定性无直接关系,故D错误。
综上所述,答案为C。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案【题目】A、B、C、D、E、F六种元素原子序数依次增大,前四种为短周期元素,E、F位于第四周期。已知A是自然界中含量最多的元素;B、C、D同周期,且B在同周期元素中第一电离能最小;C的第一、二、三电离能分别为738 kJ·mol1、1451 kJ·mol1、7733 kJ·mol1;D在同周期元素中(除稀有气体元素外)第一电离能最大;E元素为金属元素,常用于合成催化剂,其基态原子的价电子数为7;F元素的某种高价盐可用作城市饮用水的净水剂,比D的单质用于净水更安全环保,F基态原子的3d能级上有6个电子。
(1)试写出下列四种元素的元素符号:A_____;B_____;E_____;F_________。
(2)写出A、B两种元素组成的所有化合物的化学式:_____________。
(3)写出电解CD2的化学方程式:_____。
(4)E、F均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 | E | F | |
电离能/ kJ·mol1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
E元素位于第ⅦB族,请画出基态E2+的价电子排布图:_____,F元素在周期表中的位置是_____。比较两元素的I2、I3可知,气态基态E2+再失去1个电子比气态基态F2+再失去1个电子更难,对此你的解释是:_____。