题目内容
(18分)50 mL0.5mol/L盐酸跟50mL0.55mol/L氢氧化钠溶液在下图装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题。
(1)实验目的:
(2)实验用品:烧杯(500 mL和100 mL各1只)、温度计、塑料泡沫板(或硬纸板)、泡沫塑料或纸条、 (填写所缺的实验仪器);0.50mol/L盐酸、0.55mol/L NaOH溶液
(3)实验步骤:(略)
(4)问题与结论:
①完整地做一次这样的实验,需测定 次温度。
②大小烧杯间填满碎纸条、大烧杯上加盖硬纸板的作用是 。
③该实验中NaOH溶液的浓度大于盐酸浓度的作用是 。
④大烧杯上如不盖硬纸板,对求得中和热的数值有何影响: 理由:
⑤改用60 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行反应,与上述实验相比,所放热量是否相等: 所求中和热数值是否相等: 。
(1)实验目的:
(2)实验用品:烧杯(500 mL和100 mL各1只)、温度计、塑料泡沫板(或硬纸板)、泡沫塑料或纸条、 (填写所缺的实验仪器);0.50mol/L盐酸、0.55mol/L NaOH溶液
(3)实验步骤:(略)
(4)问题与结论:
①完整地做一次这样的实验,需测定 次温度。
②大小烧杯间填满碎纸条、大烧杯上加盖硬纸板的作用是 。
③该实验中NaOH溶液的浓度大于盐酸浓度的作用是 。
④大烧杯上如不盖硬纸板,对求得中和热的数值有何影响: 理由:
⑤改用60 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行反应,与上述实验相比,所放热量是否相等: 所求中和热数值是否相等: 。
(每空2分,共18分)(1)测定中和热 (2)环形玻璃棒
(4)① 3次 ②保温、隔热,减少实验过程中热量的损失
③保证盐酸充分反应 ④所得中和热数值偏低,热量损失。⑤ 不等,相等
(4)① 3次 ②保温、隔热,减少实验过程中热量的损失
③保证盐酸充分反应 ④所得中和热数值偏低,热量损失。⑤ 不等,相等
考查中和热的测定、误差分析及反应热的有关计算等。
(1)根据实验过程可知,该实验目的测定中和热。
(2)由于在实验过程中,需要搅拌,所以还缺少环形玻璃棒。
(4)①反应前需要称量酸和碱的温度,反应结束后还需要测量反应混合液的温度,所以需要3次。
②由于该实验要尽可能的减少热量的损失,所以大小烧杯间填满碎纸条、大烧杯上加盖硬纸板的作用是保温、隔热,减少实验过程中热量的损失的。
③为了保证盐酸充分反应,所以氢氧化钠是过量的。
④大烧杯上如不盖硬纸板,则会导致热量的损失,所以所得中和热数值偏低。
⑤如果改变酸或碱的用量,则反应中生成的水的物质的量是不变的,因此反应中放出的热量是变化的。但由于中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,与酸碱的用量无关,因此所求中和热数值是不变的。
(1)根据实验过程可知,该实验目的测定中和热。
(2)由于在实验过程中,需要搅拌,所以还缺少环形玻璃棒。
(4)①反应前需要称量酸和碱的温度,反应结束后还需要测量反应混合液的温度,所以需要3次。
②由于该实验要尽可能的减少热量的损失,所以大小烧杯间填满碎纸条、大烧杯上加盖硬纸板的作用是保温、隔热,减少实验过程中热量的损失的。
③为了保证盐酸充分反应,所以氢氧化钠是过量的。
④大烧杯上如不盖硬纸板,则会导致热量的损失,所以所得中和热数值偏低。
⑤如果改变酸或碱的用量,则反应中生成的水的物质的量是不变的,因此反应中放出的热量是变化的。但由于中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,与酸碱的用量无关,因此所求中和热数值是不变的。

练习册系列答案
相关题目
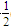 O2(g)===CO(g) ΔH2
O2(g)===CO(g) ΔH2