题目内容
【题目】我国产铜主要取自黄铜矿(CuFeS2),随着矿石品味的降低和环保要求的提高,湿法炼铜的优势日益突出。该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法。
I.氧化浸出
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有SO42-生成。
①该反应的离子方程式为 。
②该反应在25—50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因为 。
Ⅱ.配位浸出
反应原理为:![]()
(2)为提高黄铜矿的浸出率,可采取的措施有 (至少写出两点)。
(3)为稳定浸出液的pH,生产中需要向氨水中添加NH4C1,构成NH3·H2O-NH4Cl缓冲溶液。某小组在实验室对该缓冲体系进行了研究:25℃时,向amol·L-l的氨水中缓慢加入等体积0.02 mol·L-l的NH4C1溶液,平衡时溶液呈中性。则NH3·H2O的电离常数Kb= (用含a的代数式表示);滴加NH4C1溶液的过程中水的电离平衡 (填“正向”、“逆向”或“不”)移动。
Ⅲ.生物浸出
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
(4)在微生物的作用下,可以循环使用的物质有 (填化学式),微生物参与的离子反应方程式为____ (任写一个)。

(5)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2 mol SO42-生成时,理论上消耗O2的物质的量为_____________。
【答案】(1)①2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O
②H2O2受热分解;产物Cu2+、Fe3+催化H2O2分解等
(2)提高氨水的浓度、提高氧压(其他合理答案也可给分)
(3)![]() ;正向
;正向
(4)Fe2(SO4)3、H2SO4 (或Fe3+、H+ );
4Fe2++O2+4H+![]() 4Fe3++2H2O或S8+12O2+8H2O
4Fe3++2H2O或S8+12O2+8H2O![]() 8SO42-+16H+任写一个
8SO42-+16H+任写一个
(5)4.25 mol
【解析】
试题分析:(1)①双氧水将黄铜矿氧化得到硫酸根和三价铁,离子方程式为:2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O;
②H2O2受热易分解,产物Cu2+、Fe3+催化H2O2分解,故答案为:H2O2受热分解;产物Cu2+、Fe3+催化H2O2分解等;
(2)增大一种反应物的浓度,可提高另一种反应物的转化率,可提高氨水的浓度、提高氧压,故答案为:提高氨水的浓度、提高氧压;
(3)在25℃下,氨水微弱电离,浓度约为0.5a,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3H2O的电离常数Kb=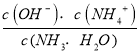 =
=![]() =
=![]() ;铵根能与氢氧根结合,促进水的电离,故答案为:正向;
;铵根能与氢氧根结合,促进水的电离,故答案为:正向;
(4)由图知Fe2(SO4)3、H2SO4是中间产物,可循环使用,离子反应方程式为4Fe2++O2+4H+![]() 4Fe3++2H2O,故答案为:Fe2(SO4)3、H2SO4;4Fe2++O2+4H+
4Fe3++2H2O,故答案为:Fe2(SO4)3、H2SO4;4Fe2++O2+4H+![]() 4Fe3++2H2O;
4Fe3++2H2O;
(5)铁元素最终全部转化为Fe3+,硫元素转化为硫酸根,当有2mol SO42-生成时,失去电子工17mol,消耗O2的物质的量为![]() =4.25mol,故答案为:4.25 mol。
=4.25mol,故答案为:4.25 mol。

 阅读快车系列答案
阅读快车系列答案【题目】下列对事实的解释不正确的是
选项 | 事实 | 解释 |
A | 用铝罐槽车储运浓硫酸 | 常温下,铝与浓硫酸不反应 |
B | 在蔗糖中加入浓硫酸后出现发黑 | 浓硫酸具有脱水性 |
C | 浓硝酸在光照下颜色变黄 | 浓HNO3不稳定,生成的有色产物NO2能溶于浓硝酸 |
D | SO2能使溴水褪色 | SO2具有还原性 |
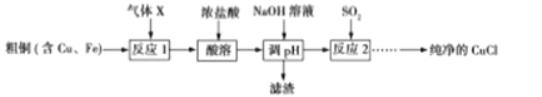
【题目】除金、铂等极少数金属外,绝大多数金属元素以化合物形式存在于自然界中,将金属元素从其化合物中还原出来的工业工程称为金属的冶炼。下列材料描述了一些常见金属的冶炼方法。
①工业上冶炼镁的方法有两种,电解法和皮江法。电解法是电解熔融的氯化镁;皮江法是硅在高温下还原氧化镁。
②霍尔-埃鲁铝电解法是以氧化铝为原料、冰晶石(Na3AlF6)为熔剂组成的电解质,在950-970℃的条件下通过电解的方法使电解质熔体中的氧化铝分解为铝和氧气。
③湿法炼铜是工业上常用的一种炼铜的方法。使用铁和硫酸铜溶液反应。
④工业上冶炼银的方法是加热条件下让氧化银分解。
⑤冶炼锰一般用铝热法,即在高温下用铝还原二氧化锰。
⑥相关各物质熔点见下表:
物质 | Al2O3 | AlCl3 | MgO | MgCl2 | Al | Mn | Mg |
熔点/℃ | 2303 | 190 | 2800 | 712 | 660 | 1244 | 649 |
Ⅰ根据上述信息回答下列问题:
(1)影响金属冶炼方法的首要因素是 。
(2)冶炼镁时电解熔融MgCl2而不电解熔融MgO,冶炼铝时电解熔融Al2O3而不电解熔融AlCl3的原因是 。
(3)写出铝热法冶炼锰的化学方程式 ,一般使用铝热法冶炼的金属具有哪些性质 。
Ⅱ下面是皮江法冶炼镁的工业流程示意图
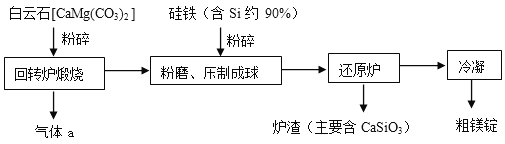
(1)气体a是 。
(2)白云石煅烧前粉碎的目的是 。
(3)还原炉需控制温度为1200℃左右,并抽空气到近似真空。还原炉中发生的主要反应有 、 。
(4)还原炉中抽空气到近似真空的原因是 。