题目内容
【题目】(14分)铜是一种常见的金属元素,其有多种用途广泛的化合物。
I、氯化亚铜(CuCl)是一种白色粉末,不溶于乙醇,微溶于水,易溶于浓盐酸,露置在空气中迅速被氧化成碱式盐。可用于一氧化碳、乙炔等气体含量的测定。以粗铜(含Cu、Fe)为原料可制备纯净的CuCl,其流程如下:
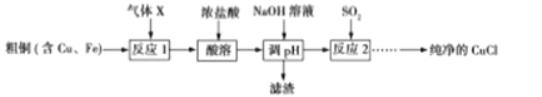
(1)气体X的化学式 ,“酸溶”采用浓盐酸的原因是 。
(2)“酸溶”所得溶液成分分析:c(CuCl2)=5mol·L-1,c(FeCl3)=1 mol·L-1。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=4.8×10-20,当溶液中金属离子的浓度小于10-5 mol·L-1时可认为其沉淀完全,则上述流程中滴加NaOH溶液调节pH,其范围约为 (数值取整数)。
(3)反应2的离子方程式为 。
(4)设计实验提纯析出的CuCl粗晶体: 。
II、纳米氧化亚铜(Cu2O)可用作光电材料,可用电解法制得(如图)。酸性介质中Cu2O不能稳定存在,潮湿的空气中可缓慢被氧化成CuO。
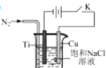
(5)阳极的电极反应式为: 。
(6)电解过程中从烧杯底部通入N2,其可能的作用:
①搅动溶液,使OH-迅速扩散;② 。
【答案】
(1)Cl2;抑制Fe3+、Cu2+的水解,且不引入杂质
(2)3~4
(3)2Cu2++SO2+2Cl-+2H2O=2CuCl↓+SO42-+4H+
(4)将CuCl粗晶体用蒸馏水洗涤后再用无水乙醇冲洗,最后真空烘干
(5)2Cu-2e-+2OH-=Cu2O+H2O
(6)作为保护气防止空气中的氧气氧化电解产生的Cu2O
【解析】
试题分析:I、(1)根据(2)的提示,反应1生成了CuCl2和FeCl3,因此气体X为氯气,“酸溶”采用浓盐酸可以抑制Fe3+、Cu2+的水解,且不引入杂质,故答案为:Cl2;抑制Fe3+、Cu2+的水解,且不引入杂质;
(2)溶度积常数越小的越先沉淀,根据溶度积常数知,先生成沉淀的是Fe(OH)3,当c(Fe3+)=10-5 mol·L-1时, c(OH-)=![]() =
=![]() ×10-11mol/L,此时溶液的pH在3~4之间,c2(OH-)·c(Cu2+)=(
×10-11mol/L,此时溶液的pH在3~4之间,c2(OH-)·c(Cu2+)=(![]() ×10-11mol/L)2×5mol·L-1<4.8×10-20,Cu2+不会沉淀,故答案为:3~4;
×10-11mol/L)2×5mol·L-1<4.8×10-20,Cu2+不会沉淀,故答案为:3~4;
(3)反应2是通入的二氧化硫将氯化铜还原为CuCl,离子方程式为2Cu2++SO2+2Cl-+2H2O=2CuCl↓+SO42-+4H+,故答案为:2Cu2++SO2+2Cl-+2H2O=2CuCl↓+SO42-+4H+;
(4)根据题意,氯化亚铜(CuCl)是一种白色粉末,不溶于乙醇,微溶于水,易溶于浓盐酸,露置在空气中迅速被氧化成碱式盐。提纯析出的CuCl粗晶体的步骤为:将CuCl粗晶体用蒸馏水洗涤后再用无水乙醇冲洗,最后真空烘干,故答案为:将CuCl粗晶体用蒸馏水洗涤后再用无水乙醇冲洗,最后真空烘干;
II、(5)阳极发生氧化反应,阳极铜失去电子生成铜两种,与溶液中阴极生成的氢氧根离子反应生成氧化亚铜,电极反应式为2Cu-2e-+2OH-=Cu2O+H2O,故答案为:2Cu-2e-+2OH-=Cu2O+H2O;
(6)电解过程中从烧杯底部通入N2,其可能的作用:①搅动溶液,使OH-迅速扩散;②作为保护气防止空气中的氧气氧化电解产生的Cu2O,故答案为:作为保护气防止空气中的氧气氧化电解产生的Cu2O。

 寒假学与练系列答案
寒假学与练系列答案