题目内容
【题目】【化学——选修3:物质结构与性质】
请回答下列问题:
(1)写出硅原子基态时的核外电子排布式:______________。硅元素位于元素周期表的第_________族。
(2)从晶体类型来看,金刚石属于_________晶体。
(3)甲烷分子中碳原子的杂化方式为________。SO42-的空间构型为_______________。
(4)实验测定HF的相对分子质量时,实验测定值一般高于理论值的原因是______________。
(5)NaCl和CsCl熔点高的是 ,(填化学式)其主要原因是 。
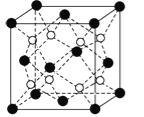
(6)CaF2晶胞结构如图所示,该晶体的密度为a g/cm3,则晶胞的体积是 (只要求列出算式)。
【答案】(1)1s22s22p63s23p2(2分)IVA(1分)
(2)原子(1分)
(3)sp3(2分)正四面体(2分)
(4)HF分子之间存在氢键,形成缔合分子(2分)
(5)NaCl(1分)由于两种物质微粒所带电荷相同,钠离子半径小于铯离子,晶体晶格能大,所以NaCl离子晶体的熔高(2分)
(6)![]() (2分)
(2分)
【解析】
试题分析:(1)硅原子核电荷数为14,其基态时的核外电子排布式为1s22s22p63s23p2,硅元素位于元素周期表的第三周期第IVA族;
(2)金刚石为立体网状结构,属于原子晶体;
(3)甲烷分子中碳原子有4个价电子,碳的杂化方式为sp3;SO42-中S形成4个σ键,孤对电子数为(6+2-2×4)÷2=0,为sp3杂化,为四面体结构;
(4)HF分子之间存在氢键,形成缔合分子,则实验测定HF的相对分子质量时,测定值一般高于理论值;
(5)由于NaCl和CsCl所带电荷相同,钠离子半径小于铯离子,晶体晶格能大,所以NaCl离子晶体的熔高;
(6)根据晶胞结构可知,每个F-的配位数为4,则Ca2+配位数为8,晶胞中Ca2+数目=8×1/8+6×1/2=4,F-数目为8,晶胞的质量为4×78/NAg,该晶体的密度为ag/cm3,则晶胞的体积=![]() =
=![]() 。
。

 阅读快车系列答案
阅读快车系列答案