题目内容
【题目】请用下列仪器和药品组成一套由含有硫化钙杂质的电石进行乙炔气体的制备、净化、检验,并可通过计算确定乙炔产率的系列实验装置,溴水的浓度为0.1 mol/L,体积是20mL,NaOH溶液足量。
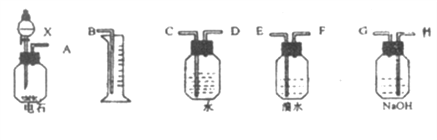
(1)如果所制气体从左到右流向时,进行实验时仪器的正确连接顺序是(填A、B、…) ____ 接 ; 接 ; 接 ; 接 。
(2)为了使实验中气流平稳,液体X通常用_________________________。
(3)实验中盛溴水的瓶中可观察到的现象是_________________________。
(4)假定溴水与乙炔完全反应,生成C2H2Br4,用含amol碳化钙的电石Wg与足量X反应,反应完全后,量筒内排入了VL液体(在标准状况下测定),则乙炔的产率为_____________________(只需列出算式)。
【答案】 A,H,G,E,F,D,C,B 饱和食盐水 溴水褪色 ![]()
【解析】由题中信息可知,电石与水反应生成的乙炔中含有硫化氢,该气体经氢氧化钠溶液洗气后,硫化氢可以被氢氧化钠溶液吸收,气体再通入溴水中与溴发生加成反应,乙炔与溴的加成产物为无色液体,余气经排水测气可以测出剩余气体的体积。
(1)如果所制气体从左到右流向时,进行实验时仪器的正确连接顺序是A接H、 G接E、F接D、C接B。
(2)为了使实验中气流平稳,液体X通常用饱和食盐水。
(3)实验中盛溴水的瓶中可观察到的现象是溴水褪色。
(4)假定溴水与乙炔完全反应,生成C2H2Br4,20mL 0.1 mol/L的溴水中含0.002mol Br2,可以吸收0.001mol的乙炔。含amol碳化钙的电石Wg与足量X反应,理论上可以生成a mol 乙炔,反应完全后,量筒内排入了VL液体(在标准状况下测定),说明剩余乙炔的物质的量为![]() mol,则乙炔的产率为
mol,则乙炔的产率为![]() 。
。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案