题目内容
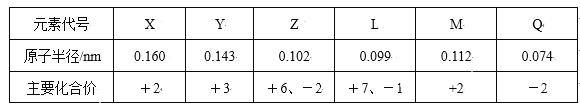
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
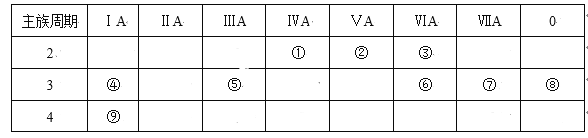
(1)在这些元素中,化学性质最不活泼的是:_____(填具体化学用语,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是______,碱性最强的化合物的电子式是:_____。
(3)最高价氧化物是两性氧化物的元素是___;写出它的氧化物与氢氧化钠反应的离子方程式__。
(4)②氢化物与③的单质在一定条件下反应的化学方程式为:______。
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因________。
(6)用结构式表示元素①与③形成的化合物____,该化合物在固体时俗称___,属于____晶体,指出它的一种用途___。
【答案】Ar HClO4 ![]() Al Al2O3+2OH-=2AlO2-+H2O 4NH3+5O2
Al Al2O3+2OH-=2AlO2-+H2O 4NH3+5O2![]() 4NO+6H2O或4NH3+3O2
4NO+6H2O或4NH3+3O2![]() 2N2+6H2O 3NO2+H2O=2HNO3+NO O=C=O 干冰 分子 人工降雨
2N2+6H2O 3NO2+H2O=2HNO3+NO O=C=O 干冰 分子 人工降雨
【解析】
由元素在周期表中的位置分析元素的种类,进而根据元素周期律及元素性质分析解答。
由元素在周期表中的位置可知,①为C,②为N,③为O,④为Na,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,
(1)上述元素中,最不活泼的为稀有气体Ar,
故答案为:Ar;
(2)最高价氧化物的水化物中,酸性最强的化合物的分子式为HClO4;碱性最强的化合物为KOH,其电子式是![]() ,
,
故答案为:HClO4;![]() ;
;
(3)最高价氧化物是两性氧化物的元素是Al,其氧化物与氢氧化钠反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O,离子方程式为:Al2O3+2OH-═2AlO2-+H2O;
故答案为:Al;Al2O3+2OH-═2AlO2-+H2O;
(4)②氢化物为氨气,③的单质为氧气,在一定条件下反应的化学方程式为4NH3+5O2![]() 4NO+6H2O或4NH3+3O2
4NO+6H2O或4NH3+3O2![]() 2N2+6H2O,
2N2+6H2O,
故答案为:4NH3+5O2![]() 4NO+6H2O或4NH3+3O2
4NO+6H2O或4NH3+3O2![]() 2N2+6H2O;
2N2+6H2O;
(5)②为N,红棕色气体为二氧化氮,可以与水反应,故不可以用排水法收集,方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(6)用结构式表示元素①与③形成的化合物为二氧化碳,结构式为:O=C=O;该化合物在固体时俗称干冰;属于分子晶体;它的一种用途是人工降雨,
故答案为:O=C=O;干冰;分子;人工降雨。